丁二烯
| 1,3-丁二烯 | |||
|---|---|---|---|
| |||

| |||
| IUPAC名 1,3-丁二烯 | |||
| 別名 | 1,3-丁二烯、二乙烯、聯乙烯 | ||
| 識別 | |||
| CAS號 | 106-99-0 | ||
| PubChem | 7845 | ||
| ChemSpider | 7557 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | KAKZBPTYRLMSJV-UHFFFAOYAZ | ||
| UN編號 | 1010 | ||
| EINECS | 271-039-0 | ||
| ChEBI | 39478 | ||
| RTECS | EI9275000 | ||
| KEGG | C16450 | ||
| 性質 | |||
| 化學式 | C4H6 | ||
| 莫耳質量 | 54.0916 g·mol⁻¹ | ||
| 外觀 | 無色氣體 或冷凍液體 | ||
| 氣味 | 輕度芳香或類似汽油 | ||
| 密度 | 0.6149 g/cm3 at 25 °C, 固體 0.64 g/cm3 at −6 °C, 液體 | ||
| 熔點 | −108.9 °C, 164.3 K, −164.0 °F | ||
| 沸點 | −4.4 °C(269 K) | ||
| 溶解性(水) | 0.735 g/100 mL | ||
| 溶解性 | 非常易溶於丙酮 溶於乙醚,乙醇 | ||
| 折光度n D |
1.4292 | ||
| 黏度 | 0.25 cP at 0 °C | ||
| 危險性 | |||
| 警示術語 | R:R45 R46 R12 | ||
| 安全術語 | S:S45 S53 | ||
| MSDS | ECSC 0017 | ||
| 主要危害 | 易燃,有刺激性,致癌物質 | ||
| NFPA 704 | |||
| 爆炸極限 | 2–12% | ||
| 致死量或濃度: | |||
LD50(中位劑量)
|
548 mg/kg(大鼠,口服) | ||
| 相關物質 | |||
| 相關烯烴 和 二烯烴 |
異戊二烯 氯丁二烯 | ||
| 相關化學品 | 丁烷 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
1,3-丁二烯簡稱丁二烯,是分子式為C4H6的有機化合物,一種重要的化工原料,可作為單體用於製造合成橡膠(丁苯橡膠、順丁橡膠、丁腈橡膠、氯丁橡膠)。當這個詞丁二烯被使用的情況下,大多數時候是指1,3 - 丁二烯。
這個名稱丁二烯還可以指同分異構體:1,2-丁二烯,它是一個累積二烯烴。然而,這種丁二烯難以製備,並且沒有工業價值。
歷史
[編輯]法國化學家E. Caventou於1863年從戊醇熱分解的產物中分離丁二烯。[1]它之後由亨利·愛德華·阿姆斯特朗在1886年從石油分離並確認。[2]
結構
[編輯]
1,3-丁二烯分子中,碳原子都是以sp2方式雜化成鍵,每個碳原子還有一個垂直於分子平面的p軌道,相互平行重疊構成一個離域大π鍵。 1,3-丁二烯的最穩定構象是s-反式構象,兩對雙鍵分別處於C-C單鍵的兩側,此時空間效應最小,兩種構象的能壘相差24.8 kJ/mol(5.9 kcal/mol)。[3]
即使1,3-丁二烯的s-順式構象有更高的能量,但仍會以此構象作為四電子組分參與協同的環加成反應,如Diels-Alder反應。
經過實驗和計算,s-反-1,3-丁二烯的雙鍵鍵長為133.8pm,而乙烯中的碳碳雙鍵鍵長為133.0pm,這也被認為是π鍵被離域效應削弱和增長的證據,可見如圖所示的共振結構式。[4]
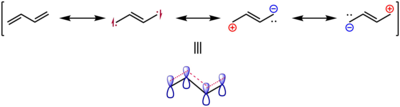
並且,1,3-丁二烯中的碳碳單鍵的鍵長也明顯小於烷烴中碳碳單鍵的鍵長,這種現象被稱為鍵長的平均化,是共軛烯烴的特徵之一。
性質
[編輯]丁二烯是無色有微弱芳香氣味的無色易液化氣體,難溶於水,可溶於醇、醚、丙酮、苯等有機溶劑。在氧氣存在下容易發生聚合。
1,3-丁二烯分子中的碳-碳單鍵可以自由旋轉,但無順式和反式異構體。丁二烯還有另一種異構體:1,2-丁二烯,它是一個累積二烯烴,與1,3-丁二烯相比非常不穩定。
丁二烯是狄爾斯-阿爾德反應常用的雙烯體之一,它與缺電子親雙烯體發生狄爾斯-阿爾德反應,可以製取蒽醌、四氫苯酐、丁烷四羧酸、六氫苯二甲酸酐等很多化工產品。丁二烯也可以與二氧化硫發生螯變反應,然後加氫生成工業溶劑環丁碸。
當把丁二烯通入溴水,起加成反應時,除了生成溴直接和雙鍵加成生成的1-二溴丁烯外,還生成2-二溴丁烯——在加成時,兩個雙鍵中比較活潑的鍵一起斷裂,同時生成新的雙鍵。如果丁二烯通入得較慢,而且溴水又多又濃,最後會生成1,1,3,3-四溴丁烷。
生產
[編輯]丁二烯的工業生產方法有:
從C4烴提取
[編輯]此法目前應用於美國、西歐和日本。乙烯裝置副產C4抽提(脂肪烴於900°C以上發生水蒸氣裂解製取乙烯和其他烯烴時的副產品)。此法正逐步替代其他方法,成為製取丁二烯的主要方法。生成的丁二烯可通過乙腈或二甲基甲醯胺等極性非質子溶劑萃取出來,並蒸餾提純。[5]
從正丁烷的脫氫
[編輯]通過丁烷或丁烯催化脫氫生產。首個用此丁烷脫氫法生產丁二烯的工廠於1957年建於美國休斯頓,年產65000噸丁二烯。此法正被逐步淘汰。
從乙醇
[編輯]參見
[編輯]參考資料
[編輯]- ^ Caventou, E. Ueber eine mit dem zweifach-gebromten Brombutylen isomere Verbindung und über die bromhaltigen Derivate des Brombutylens. Justus Liebigs Annalen der Chemie. 1863, 127: 93–97 [2022-12-12]. doi:10.1002/jlac.18631270112. (原始內容存檔於2022-12-12).
- ^ Armstrong, H. E.; Miller, A. K. The decomposition and genesis of hydrocarbons at high temperatures. I. The products of the manufacture of gas from petroleum. J. Chem. Soc. 1886, 49: 74–93 [2022-12-12]. doi:10.1039/CT8864900074. (原始內容存檔於2022-12-12).
- ^ Feller, David; Craig, Norman C. High Level ab Initio Energies and Structures for the Rotamers of 1,3-Butadiene. The Journal of Physical Chemistry A. 2009-02-26, 113 (8): 1601–1607. Bibcode:2009JPCA..113.1601F. ISSN 1089-5639. PMID 19199679. doi:10.1021/jp8095709 (英語).
- ^ Craig, Norman C.; Groner, Peter; McKean, Donald C. Equilibrium Structures for Butadiene and Ethylene: Compelling Evidence for Π-Electron Delocalization in Butadiene. The Journal of Physical Chemistry A. 2006-06-01, 110 (23): 7461–7469. Bibcode:2006JPCA..110.7461C. ISSN 1089-5639. PMID 16759136. doi:10.1021/jp060695b.
- ^ Sun, H.P. Wristers, J.P. (1992). Butadiene. In J.I. Kroschwitz (Ed.), Encyclopedia of Chemical Technology, 4th ed., vol. 4, pp. 663–690. New York: John Wiley & Sons.
- ^ Kirshenbaum, I. (1978). Butadiene. In M. Grayson (Ed.), Encyclopedia of Chemical Technology, 3rd ed., vol. 4, pp. 313–337. New York: John Wiley & Sons.
- ^ 丁二烯字典-Guidechem.com(英文). [2012-01-09]. (原始內容存檔於2020-11-07).
| ||||||||||||||||||||||



