Weinreb酮合成
| Weinreb酮合成 | |
|---|---|
| 命名根据 | 史蒂芬·M·温勒伯 史蒂芬·纳姆 |
| 反应类型 | 偶联反应 |
| 标识 | |
| 有机化学网站对应网页 | weinreb-ketone-synthesis |
Weinreb酮合成(英语:Weinreb ketone synthesis,温勒伯酮合成法)或称Weinreb-Nahm酮合成,是有机化学中一种构建碳-碳键的有机反应。它由Weinreb酰胺(N-甲氧基-N-甲基酰胺,WAs)出发,经有机金属亲核试剂处理制备醛和酮[1]。最初是由史蒂芬·M·温勒伯和史蒂芬·纳姆于1981年发现的酮合成方法,最初的报道由两个亲核酰基取代反应组成:由酰氯与N,O-二甲羟胺盐酸盐反应得到Weinreb酰胺,再使用有机金属试剂处理得即可。
Weinreb酮合成的特点在于,金属亲核试剂使用格氏试剂、有机锂试剂或磷叶立德[2]时,可以成酮[1];使用过量的金属氢化物例如LAH或DIBAL,可以成醛[3];并且过量的金属试剂也不会使羰基被过度的还原为羟基。

以Weinreb-Nahm酰胺为原料的酮合成法被有机化学家们广泛使用,经常能发现含有此结构的天然产物,并能灵活地构建新的碳-碳键或是转化为其他官能团。此反应被用于许多合成中,例如大环内酯类免疫抑制剂Macrosphelide A和B[4]、海洋天然产物大环内酯类Amphidinolide J[5]和聚酮类抗生素Spirofungins A和B[6](见下文)。
机理
[编辑]Weinreb和Nahm提出了以下反应机理来解释Weinreb-Nahm酰胺所表现出的特性,他们认为反应是通过一个假想的四面体中间体进行的(A),该四面体由于甲氧基的螯合作用而稳定,以解释羰基没有被进一步加成的原因[1],四面体仅能在低温下存在,并在加入酸性水溶液后转变为醛或酮,过量的金属试剂也被淬灭[7]。

此种螯合作用的机理虽然在当时就得到了学界的认可,但直至2006年才经光谱和动力学分析研究证实[8]。
特点
[编辑]以Weinreb法合成醛酮有以下优点[7]:
- 相对于醛、酮制备中,常用的活泼的羧酸衍生物(如:酰氯),温勒伯酰胺稳定易贮藏;
- 反应的条件较温和,操作简便,所用试剂如有机锂试剂、格氏试剂、金属氢化物等是实验室常用试剂;
- 反应进程可控,加入过量的金属试剂会形成螯合物,反应生成稳定的四面体过渡态阻止羰基的后续加成;
- 能广泛应用于羧酸及其衍生物的官能团转化,合成脂肪酮,α、β-不饱和烯酮,芳香酮,炔酮等,并且可在固相合成中实现。

在使用强碱性或空间位阻大的亲核试剂时,可能发生Weinreb酰胺中N-O键断裂的现象,导致发生脱甲氧基放出甲醛的副反应[9]。此外,脱甲氧基反应在WAs参与的过渡金属催化加氢反应中也见报道[10]。非金属的电中性超电子给体利用单电子转移过程,也可通过自由基机理发生N-O键的断裂[11]。

制备
[编辑]除上文所述的方法,Weinreb酰胺还可通过多种羧酸衍生物制备,如羧酸、酰氯、酯 [12][13][14][15],所用试剂主要为有机铝试剂,如三甲基铝以及更加方便的二异丁基氢化铝等[16] 。格氏试剂与N,O-二甲羟胺盐酸盐(MeO(Me)NH•HCl)再与酯或内酯反应,也可以得到Weinreb酰胺[17]。
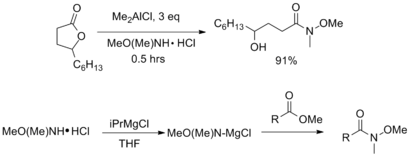
许多肽偶联试剂也用于从羧酸起始制备Weinreb酰胺,有多种碳二亚胺、1-羟基苯并三唑和三苯基膦为基底的偶联剂被专用于此合成目的[17][16]。

史蒂芬·L·布赫瓦尔德报告了一种方便、直接的将芳基卤化物转化为芳基Weinreb酰胺的胺基羰基化反应(aminocarbonylation)[18]。

范围
[编辑]标准的Weinreb酮合成允许分子中含有各种官能团,包括α-卤素、N-保护的氨基酸、α,β-不饱和键、硅醚、各种内酯或内酰胺结构、磺酸酯或亚磺酸酯和膦酸酯 [17][16]。亲核试剂最常用的是有机锂试剂和格氏试剂,主要是脂肪族、乙烯基、芳香基和炔基亲核体。
Weinreb-Nahm酰胺在复杂天然产物分子的合成中有重要应用,是许多碎片分子的重要偶联剂。下图中为大环内酯类分子Amphidinolide J、Macrosphelide A和B和聚酮类分子Spirofungins A和B在合成过程中涉及Weinreb酰胺的关键步[4][5][6]。

反应变体
[编辑]当受底物中其他官能团的限制而无法使用金属氢化物或格氏试剂时,可以通过Wittig反应得到α,β-不饱和WAs,随后经酸性水溶液处理得到醛或酮[19]。在实际应用中,有报道使用含叶立德Weinreb酰胺与单糖进行Wittig反应构建C-C键,再将修饰后的Weinreb酰胺与芳基格氏试剂反应,得到了具抗癌活性的二苯酮衍生物Phenstatin类似物[20]。

Conrad等人开发了一种一锅法由芳卤合成α-氨基芳基酮的方法,该方法可以保留原始酰胺的手性 [21]:
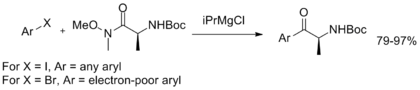
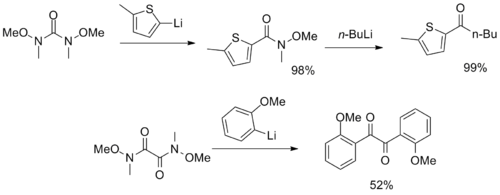
对多元Weinreb酰胺分子,能够作为合成CO2 和二酮的合成子 [22][23]:
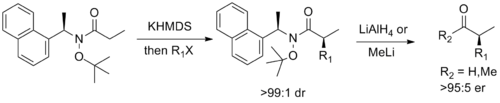
斯蒂芬·G·戴维斯设计了一种手性助剂,它是Weinreb酰胺的等价物,结合了Weinreb酰胺和Myers的伪麻黄碱手性助剂[锚点失效]的功能性,可以进行高非对映选择性的烯醇烷基化反应,随后能裂解为相应的对映体醛或酮[24]。
参见
[编辑]参考资料
[编辑]- ^ 1.0 1.1 1.2 Nahm, S.; Weinreb, S. M., N-methoxy-n-methylamides as effective acylating agents, Tetrahedron Letters, 1981, 22 (39): 3815–3818, doi:10.1016/s0040-4039(01)91316-4
- ^ John A. Murphy, Aurélien G. J. Commeureuc, Thomas N. Snaddon, Thomas M. McGuire, Tanweer A. Khan, Kevin Hisler, Mark L. Dewis, and Robert Carling. Direct Conversion of N-Methoxy-N-methylamides (Weinreb Amides) to Ketones via a Nonclassical Wittig Reaction. Org. Lett. 2005, 7 (7): 1427–1429. doi:10.1021/ol050337b.
- ^ Goel, O. P.; Krolls, U.; Stier, M.; Kesten, S. "N-tert-Butoxycarbonyl-L-leucinal (页面存档备份,存于互联网档案馆)". Organic Syntheses, Coll. Vol. 8, p.68 (1993); Vol. 67, p.69 (1989).
- ^ 4.0 4.1 Paek, S.-M.; Seo, S.-Y.; Kim, S.-H.; Jung, J.-W.; Lee, Y.-S.; Jung, J.-K.; Suh, Y.-G., Concise Syntheses of (+)-Macrosphelides A and B, Organic Letters, 2005, 7 (15): 3159–3162, PMID 16018610, doi:10.1021/ol0508429
- ^ 5.0 5.1 Barbazanges, M.; Meyer, C.; Cossy, J., Total Synthesis of Amphidinolide J, Organic Letters, 2008, 10 (20): 4489–4492, PMID 18811171, doi:10.1021/ol801708x
- ^ 6.0 6.1 Shimizu, T.; Satoh, T.; Murakoshi, K.; Sodeoka, M., Asymmetric Total Synthesis of (−)-Spirofungin A and (+)-Spirofungin B, Organic Letters, 2005, 7 (25): 5573–5576, PMID 16320994, doi:10.1021/ol052039k
- ^ 7.0 7.1 赵蔚; 刘伟. Weinreb酰胺在有机合成中的应用进展. Chinese J. Org. Chem. 2015, 35 (01): 55–69. doi:10.6023/cjoc201407032.
- ^ Qu, B.; Collum, D. B., Mechanism of Acylation of Lithium Phenylacetylide with a Weinreb Amide, J. Org. Chem., 2006, 71 (18): 7117–7119, PMID 16930080, doi:10.1021/jo061223w
- ^ Graham, S. L.; Scholz, T. H. A new mode of reactivity of N-methoxy-N-methylamides with strongly basic reagents. Tetrahedron Lett. 1990, 31 (44): 6269–6272. ISSN 0040-4039. doi:10.1016/S0040-4039(00)97039-4.
- ^ Fukuzawa, H.; Ura, Y.; Kataoka, Y. Ruthenium-catalyzed reduction of N-alkoxy- and N-hydroxyamides. J. Organomet. Chem. 2011, 696 (23): 3643–3648. doi:10.1016/j.jorganchem.2011.08.026.
- ^ Sword, R.; O'Sullivan, S.; Murphy, J. A. A Novel Organic Electron Donor Derived from N-Methylisatin. Aust. J. Chem. 2013, 66: 314–322. doi:10.1071/CH12480.
- ^ Fehrentz, Jean-Alain; Castro, Bertrand. An Efficient Synthesis of Optically Active α-(t-Butoxycarbonylamino)-aldehydes from α-Amino Acids. Synthesis. 1983, (8): 676. doi:10.1055/s-1983-30471.
- ^ Lidia De Luca, Giampaolo Giacomelli, and Maurizio Taddei. An Easy and Convenient Synthesis of Weinreb Amides and Hydroxamates. J. Org. Chem. 2001, 66 (7): 2534–2537. doi:10.1021/jo015524b.
- ^ Jacqueline C. S. Woo, Erik Fenster, and Gregory R. Dake. A Convenient Method for the Conversion of Hindered Carboxylic Acids to N-Methoxy-N-methyl (Weinreb) Amides. J. Org. Chem. 2004, 69 (25): 8984–8986. doi:10.1021/jo048385h.
- ^ Ashok Rao Tunoori, Jonathan M. White, and Gunda I. Georg. A One-Flask Synthesis of Weinreb Amides from Chiral and Achiral Carboxylic Acids Using the Deoxo-Fluor Fluorinating Reagent. Org. Lett. 2000, 2 (25): 4091–4093. doi:10.1021/ol000318w.
- ^ 16.0 16.1 16.2 Mentzel, M.; Hoffmann, H. M. R., N-methoxy-N-methylamides (Weinreb amides) in modern organic synthesis, Journal für Praktische Chemie/Chemiker-Zeitung, 1997, 339: 517–524, doi:10.1002/prac.19973390194
- ^ 17.0 17.1 17.2 Singh, J.; Satyamurthi, N.; Aidhen, I. S., The Growing Synthetic Utility of Weinreb's Amide, Journal für praktische Chemie, 2000, 342: 340, doi:10.1002/(sici)1521-3897(200004)342:4<340::aid-prac340>3.0.co;2-1
- ^ Martinelli, J. R.; Freckmann, D. M. M.; Buchwald, S. L., Convenient Method for the Preparation of Weinreb Amides via Pd-Catalyzed Aminocarbonylation of Aryl Bromides at Atmospheric Pressure, Organic Letters, 2006, 8 (21): 4843–4846, PMID 17020317, doi:10.1021/ol061902t
- ^ Hisler, K.; Tripoli, R.; Murphy, J. A., Reactions of Weinreb amides: formation of aldehydes by Wittig reactions, Tetrahedron Letters, 2006, 47 (35): 6293–6295, doi:10.1016/j.tetlet.2006.06.118
- ^ Sivaraman, B.; Aidhen, I. S. Weinreb Amide Based Building Blocks for Convenient Access to Analogues of Phenstatin. Eur. J. Org. Chem. 2010, 2010 (26): 4991–5003. doi:10.1002/ejoc.201000532.
- ^ Conrad, K.; Hsiao, Y.; Miller, R., A practical one-pot process for α-amino aryl ketone synthesis, Tetrahedron Letters, 2005, 46 (49): 8587–8589, doi:10.1016/j.tetlet.2005.09.183
- ^ Whipple, W. L.; Reich, H. J., Use of N,N'-dimethoxy-N,N'-dimethylurea as a carbonyl dication equivalent in organometallic addition reactions. Synthesis of unsymmetrical ketones, J. Org. Chem., 1991, 56 (8): 2911–2912, doi:10.1021/jo00008a057
- ^ Sibi, M. P.; Sharma, R.; Paulson, K. L., N,N′-Dimethoxy-N,N -Dimethylethanediamide: A Useful α-Oxo-N-Methoxy-N-Methylamide and 1,2-Diketone Synthon, Tetrahedron Letters, 1992, 33: 1941, doi:10.1016/0040-4039(92)88108-h
- ^ Davies, S. G.; Goodwin, C. J.; Hepworth, D.; Roberts, P. M.; Thomson, J. E., On the Origins of Diastereoselectivity in the Alkylation of Enolates Derived from N-1-(1'-Naphthyl)ethyl-O-tert-butylhydroxamates: Chiral Weinreb Amide Equivalents, J. Org. Chem., 2010, 75 (4): 1214–1227, PMID 20095549, doi:10.1021/jo902499s
