Weinreb酮合成
| Weinreb酮合成 | |
|---|---|
| 命名根據 | 史蒂芬·M·溫勒伯 史蒂芬·納姆 |
| 反應類型 | 偶聯反應 |
| 標識 | |
| 有機化學網站對應網頁 | weinreb-ketone-synthesis |
Weinreb酮合成(英語:Weinreb ketone synthesis,溫勒伯酮合成法)或稱Weinreb-Nahm酮合成,是有機化學中一種構建碳-碳鍵的有機反應。它由Weinreb醯胺(N-甲氧基-N-甲基醯胺,WAs)出發,經有機金屬親核試劑處理製備醛和酮[1]。最初是由史蒂芬·M·溫勒伯和史蒂芬·納姆於1981年發現的酮合成方法,最初的報道由兩個親核醯基取代反應組成:由醯氯與N,O-二甲羥胺鹽酸鹽反應得到Weinreb醯胺,再使用有機金屬試劑處理得即可。
Weinreb酮合成的特點在於,金屬親核試劑使用格氏試劑、有機鋰試劑或磷葉立德[2]時,可以成酮[1];使用過量的金屬氫化物例如LAH或DIBAL,可以成醛[3];並且過量的金屬試劑也不會使羰基被過度的還原為羥基。

以Weinreb-Nahm醯胺為原料的酮合成法被有機化學家們廣泛使用,經常能發現含有此結構的天然產物,並能靈活地構建新的碳-碳鍵或是轉化為其他官能團。此反應被用於許多合成中,例如大環內酯類免疫抑制劑Macrosphelide A和B[4]、海洋天然產物大環內酯類Amphidinolide J[5]和聚酮類抗生素Spirofungins A和B[6](見下文)。
機理
[編輯]Weinreb和Nahm提出了以下反應機理來解釋Weinreb-Nahm醯胺所表現出的特性,他們認為反應是通過一個假想的四面體中間體進行的(A),該四面體由於甲氧基的螯合作用而穩定,以解釋羰基沒有被進一步加成的原因[1],四面體僅能在低溫下存在,並在加入酸性水溶液後轉變為醛或酮,過量的金屬試劑也被淬滅[7]。

此種螯合作用的機理雖然在當時就得到了學界的認可,但直至2006年才經光譜和動力學分析研究證實[8]。
特點
[編輯]以Weinreb法合成醛酮有以下優點[7]:
- 相對於醛、酮製備中,常用的活潑的羧酸衍生物(如:醯氯),溫勒伯醯胺穩定易貯藏;
- 反應的條件較溫和,操作簡便,所用試劑如有機鋰試劑、格氏試劑、金屬氫化物等是實驗室常用試劑;
- 反應進程可控,加入過量的金屬試劑會形成螯合物,反應生成穩定的四面體過渡態阻止羰基的後續加成;
- 能廣泛應用於羧酸及其衍生物的官能團轉化,合成脂肪酮,α、β-不飽和烯酮,芳香酮,炔酮等,並且可在固相合成中實現。

在使用強鹼性或空間位阻大的親核試劑時,可能發生Weinreb醯胺中N-O鍵斷裂的現象,導致發生脫甲氧基放出甲醛的副反應[9]。此外,脫甲氧基反應在WAs參與的過渡金屬催化加氫反應中也見報道[10]。非金屬的電中性超電子給體利用單電子轉移過程,也可通過自由基機理發生N-O鍵的斷裂[11]。

製備
[編輯]除上文所述的方法,Weinreb醯胺還可通過多種羧酸衍生物製備,如羧酸、醯氯、酯 [12][13][14][15],所用試劑主要為有機鋁試劑,如三甲基鋁以及更加方便的二異丁基氫化鋁等[16] 。格氏試劑與N,O-二甲羥胺鹽酸鹽(MeO(Me)NH•HCl)再與酯或內酯反應,也可以得到Weinreb醯胺[17]。

許多肽偶聯試劑也用於從羧酸起始製備Weinreb醯胺,有多種碳二亞胺、1-羥基苯並三唑和三苯基膦為基底的偶聯劑被專用於此合成目的[17][16]。

史蒂芬·L·布赫瓦爾德報告了一種方便、直接的將芳基鹵化物轉化為芳基Weinreb醯胺的胺基羰基化反應(aminocarbonylation)[18]。

範圍
[編輯]標準的Weinreb酮合成允許分子中含有各種官能團,包括α-鹵素、N-保護的胺基酸、α,β-不飽和鍵、矽醚、各種內酯或內醯胺結構、磺酸酯或亞磺酸酯和膦酸酯 [17][16]。親核試劑最常用的是有機鋰試劑和格氏試劑,主要是脂肪族、乙烯基、芳香基和炔基親核體。
Weinreb-Nahm醯胺在複雜天然產物分子的合成中有重要應用,是許多碎片分子的重要偶聯劑。下圖中為大環內酯類分子Amphidinolide J、Macrosphelide A和B和聚酮類分子Spirofungins A和B在合成過程中涉及Weinreb醯胺的關鍵步[4][5][6]。

反應變體
[編輯]當受底物中其他官能團的限制而無法使用金屬氫化物或格氏試劑時,可以通過Wittig反應得到α,β-不飽和WAs,隨後經酸性水溶液處理得到醛或酮[19]。在實際應用中,有報道使用含葉立德Weinreb醯胺與單糖進行Wittig反應構建C-C鍵,再將修飾後的Weinreb醯胺與芳基格氏試劑反應,得到了具抗癌活性的二苯酮衍生物Phenstatin類似物[20]。

Conrad等人開發了一種一鍋法由芳鹵合成α-氨基芳基酮的方法,該方法可以保留原始醯胺的手性 [21]:
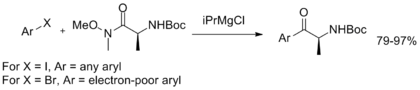
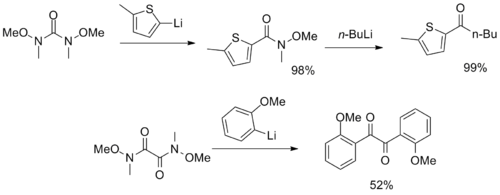
對多元Weinreb醯胺分子,能夠作為合成CO2 和二酮的合成子 [22][23]:
史蒂芬·G·戴維斯設計了一種手性助劑,它是Weinreb醯胺的等價物,結合了Weinreb醯胺和Myers的偽麻黃鹼手性助劑[錨點失效]的功能性,可以進行高非對映選擇性的烯醇烷基化反應,隨後能裂解為相應的對映體醛或酮[24]。

參見
[編輯]參考資料
[編輯]- ^ 1.0 1.1 1.2 Nahm, S.; Weinreb, S. M., N-methoxy-n-methylamides as effective acylating agents, Tetrahedron Letters, 1981, 22 (39): 3815–3818, doi:10.1016/s0040-4039(01)91316-4
- ^ John A. Murphy, Aurélien G. J. Commeureuc, Thomas N. Snaddon, Thomas M. McGuire, Tanweer A. Khan, Kevin Hisler, Mark L. Dewis, and Robert Carling. Direct Conversion of N-Methoxy-N-methylamides (Weinreb Amides) to Ketones via a Nonclassical Wittig Reaction. Org. Lett. 2005, 7 (7): 1427–1429. doi:10.1021/ol050337b.
- ^ Goel, O. P.; Krolls, U.; Stier, M.; Kesten, S. "N-tert-Butoxycarbonyl-L-leucinal (頁面存檔備份,存於網際網路檔案館)". Organic Syntheses, Coll. Vol. 8, p.68 (1993); Vol. 67, p.69 (1989).
- ^ 4.0 4.1 Paek, S.-M.; Seo, S.-Y.; Kim, S.-H.; Jung, J.-W.; Lee, Y.-S.; Jung, J.-K.; Suh, Y.-G., Concise Syntheses of (+)-Macrosphelides A and B, Organic Letters, 2005, 7 (15): 3159–3162, PMID 16018610, doi:10.1021/ol0508429
- ^ 5.0 5.1 Barbazanges, M.; Meyer, C.; Cossy, J., Total Synthesis of Amphidinolide J, Organic Letters, 2008, 10 (20): 4489–4492, PMID 18811171, doi:10.1021/ol801708x
- ^ 6.0 6.1 Shimizu, T.; Satoh, T.; Murakoshi, K.; Sodeoka, M., Asymmetric Total Synthesis of (−)-Spirofungin A and (+)-Spirofungin B, Organic Letters, 2005, 7 (25): 5573–5576, PMID 16320994, doi:10.1021/ol052039k
- ^ 7.0 7.1 趙蔚; 劉偉. Weinreb酰胺在有机合成中的应用进展. Chinese J. Org. Chem. 2015, 35 (01): 55–69. doi:10.6023/cjoc201407032.
- ^ Qu, B.; Collum, D. B., Mechanism of Acylation of Lithium Phenylacetylide with a Weinreb Amide, J. Org. Chem., 2006, 71 (18): 7117–7119, PMID 16930080, doi:10.1021/jo061223w
- ^ Graham, S. L.; Scholz, T. H. A new mode of reactivity of N-methoxy-N-methylamides with strongly basic reagents. Tetrahedron Lett. 1990, 31 (44): 6269–6272. ISSN 0040-4039. doi:10.1016/S0040-4039(00)97039-4.
- ^ Fukuzawa, H.; Ura, Y.; Kataoka, Y. Ruthenium-catalyzed reduction of N-alkoxy- and N-hydroxyamides. J. Organomet. Chem. 2011, 696 (23): 3643–3648. doi:10.1016/j.jorganchem.2011.08.026.
- ^ Sword, R.; O'Sullivan, S.; Murphy, J. A. A Novel Organic Electron Donor Derived from N-Methylisatin. Aust. J. Chem. 2013, 66: 314–322. doi:10.1071/CH12480.
- ^ Fehrentz, Jean-Alain; Castro, Bertrand. An Efficient Synthesis of Optically Active α-(t-Butoxycarbonylamino)-aldehydes from α-Amino Acids. Synthesis. 1983, (8): 676. doi:10.1055/s-1983-30471.
- ^ Lidia De Luca, Giampaolo Giacomelli, and Maurizio Taddei. An Easy and Convenient Synthesis of Weinreb Amides and Hydroxamates. J. Org. Chem. 2001, 66 (7): 2534–2537. doi:10.1021/jo015524b.
- ^ Jacqueline C. S. Woo, Erik Fenster, and Gregory R. Dake. A Convenient Method for the Conversion of Hindered Carboxylic Acids to N-Methoxy-N-methyl (Weinreb) Amides. J. Org. Chem. 2004, 69 (25): 8984–8986. doi:10.1021/jo048385h.
- ^ Ashok Rao Tunoori, Jonathan M. White, and Gunda I. Georg. A One-Flask Synthesis of Weinreb Amides from Chiral and Achiral Carboxylic Acids Using the Deoxo-Fluor Fluorinating Reagent. Org. Lett. 2000, 2 (25): 4091–4093. doi:10.1021/ol000318w.
- ^ 16.0 16.1 16.2 Mentzel, M.; Hoffmann, H. M. R., N-methoxy-N-methylamides (Weinreb amides) in modern organic synthesis, Journal für Praktische Chemie/Chemiker-Zeitung, 1997, 339: 517–524, doi:10.1002/prac.19973390194
- ^ 17.0 17.1 17.2 Singh, J.; Satyamurthi, N.; Aidhen, I. S., The Growing Synthetic Utility of Weinreb's Amide, Journal für praktische Chemie, 2000, 342: 340, doi:10.1002/(sici)1521-3897(200004)342:4<340::aid-prac340>3.0.co;2-1
- ^ Martinelli, J. R.; Freckmann, D. M. M.; Buchwald, S. L., Convenient Method for the Preparation of Weinreb Amides via Pd-Catalyzed Aminocarbonylation of Aryl Bromides at Atmospheric Pressure, Organic Letters, 2006, 8 (21): 4843–4846, PMID 17020317, doi:10.1021/ol061902t
- ^ Hisler, K.; Tripoli, R.; Murphy, J. A., Reactions of Weinreb amides: formation of aldehydes by Wittig reactions, Tetrahedron Letters, 2006, 47 (35): 6293–6295, doi:10.1016/j.tetlet.2006.06.118
- ^ Sivaraman, B.; Aidhen, I. S. Weinreb Amide Based Building Blocks for Convenient Access to Analogues of Phenstatin. Eur. J. Org. Chem. 2010, 2010 (26): 4991–5003. doi:10.1002/ejoc.201000532.
- ^ Conrad, K.; Hsiao, Y.; Miller, R., A practical one-pot process for α-amino aryl ketone synthesis, Tetrahedron Letters, 2005, 46 (49): 8587–8589, doi:10.1016/j.tetlet.2005.09.183
- ^ Whipple, W. L.; Reich, H. J., Use of N,N'-dimethoxy-N,N'-dimethylurea as a carbonyl dication equivalent in organometallic addition reactions. Synthesis of unsymmetrical ketones, J. Org. Chem., 1991, 56 (8): 2911–2912, doi:10.1021/jo00008a057
- ^ Sibi, M. P.; Sharma, R.; Paulson, K. L., N,N′-Dimethoxy-N,N -Dimethylethanediamide: A Useful α-Oxo-N-Methoxy-N-Methylamide and 1,2-Diketone Synthon, Tetrahedron Letters, 1992, 33: 1941, doi:10.1016/0040-4039(92)88108-h
- ^ Davies, S. G.; Goodwin, C. J.; Hepworth, D.; Roberts, P. M.; Thomson, J. E., On the Origins of Diastereoselectivity in the Alkylation of Enolates Derived from N-1-(1'-Naphthyl)ethyl-O-tert-butylhydroxamates: Chiral Weinreb Amide Equivalents, J. Org. Chem., 2010, 75 (4): 1214–1227, PMID 20095549, doi:10.1021/jo902499s
