磷的硫化物
磷的硫化物是一類無機化合物,只由磷和硫組成,通式為 P4Sx(x ≤ 10)。其中兩種磷的硫化物具有商業意義:十硫化四磷 (P4S10)的產量達到千噸規模,用於生產有機硫化合物;而三硫化四磷 (P4S3)可用於製造火柴。
除了 P4S3 和P4S10以外,還存在多種磷的硫化物。其中六種有異構體:P4S4、P4S5、P4S6、P4S7、P4S8和 P4S9。它們的異構體以希臘字母前綴區別。這些前綴是以發現順序排列的,而不是結構。[1] 所有已知的磷的硫化物分子的四個磷原子都為四面體型排列(類似白磷)。[2] P4S2 也是已知的,不過在 −30 °C以上不穩定。[3]
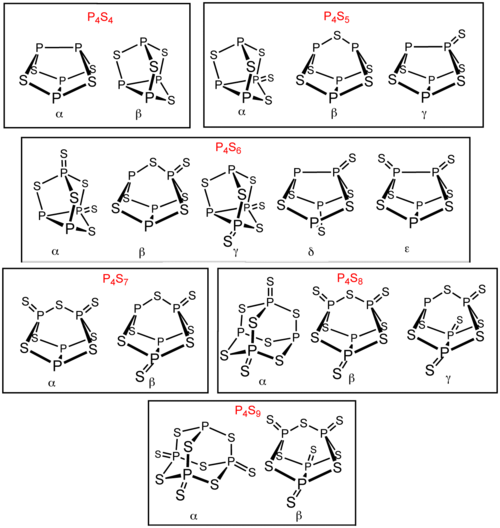
製備
[編輯]磷的硫化物的主要製備方法是加熱磷和硫的混合物。產物可以由 31P 核磁共振波譜法分析。更具選擇性的合成需要用三苯基膦脫硫,或是用硫化三苯基胂硫化。[4][5]
P4S3
[編輯]三硫化四磷可以由紅磷和硫在 450 K以上反應,[6] 然後用二硫化碳和苯小心地重結晶。另一種製備方法是將白磷和硫在惰性、不易燃的溶劑里反應而成。[7]
P4S4
[編輯]α型和β型的 P4S4可以由 P4S3I2 的對應異構體和((CH3)3Sn)2S 反應而成:[6]
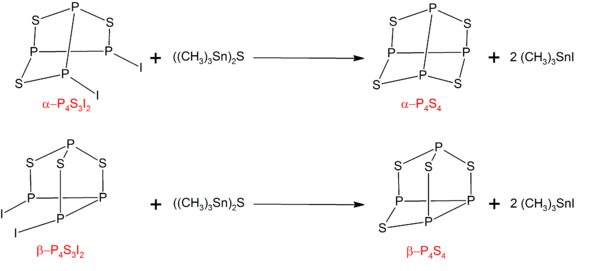
反應前體 P4S3I2 則可以由化學計量的磷、硫和碘反應而成。
P4S5
[編輯]P4S5 可以由化學計量的 P4S3 和硫的二硫化碳溶液在光照和催化量的碘下反應而成。[8]產物可以通過使用磷-31核磁共振波譜法分析。
α-P4S5 可以通過 P4S10和紅磷的光化學反應而成。[6] P4S5 是對熱不穩定的,會在達到熔點之前歧化成 P4S3 和 P4S7。[9]
P4S6
[編輯]P4S6 可以由 P4S7 被三苯基膦奪走一個硫原子而成:[6]
α-P4S5 和溶於二硫化碳的Ph3AsS 反應,也可以得到 α-P4S6。[4]兩種新的六硫化四磷異構體δ-P4S6 和ε-P4S6可以由 α-P4S4 和溶於二硫化碳的Ph3SbS 反應而成。[10]
P4S7
[編輯]P4S7 可以由磷和硫直接反應而成,是最容易提純的磷的硫化物之一。[11]
- 4 P + 7 S → P4S7
P4S8
[編輯]β-P4S8可以由 α-P4S7 和溶於二硫化碳的 Ph3AsS 反應而成,會產生α-P4S7 和β-P4S8的混合物。[4]
P4S9
[編輯]P4S9 的製備有兩種方法。一種方法是 P4S3和過量的硫加熱反應而成。[6]
另一種方法則是以1:2 的比例混合P4S7 和 P4S10,會產生 P4S9。這個反應為可逆反應:[10]
- P4S7 + 2 P4S10 ⇌ 3 P4S9
P4S10
[編輯]P4S10是最穩定的磷的硫化物之一。它可以通過在真空管中,將白磷和硫加熱到 570 K 以上而成。[12]
- P4 + 10 S → P4S10
參考資料
[編輯]- ^ Jason, M. E.; Ngo, T.; Rahman, S. Products and Mechanisms in the Oxidation of Phosphorus by Sulfur at Low Temperature. Inorg. Chem. 1997, 36 (12): 2633–2640. doi:10.1021/ic9614879.
- ^ Holleman, A. F.; Wiberg, E. Inorganic Chemistry. Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ^ Heal, H. G. The Inorganic Heterocyclic Chemistry of Sulfur, Nitrogen, and Phosphorus Academic Press: London; 1980 ISBN 0-12-335680-6.
- ^ 4.0 4.1 4.2 Jason, M. E. Transfer of Sulfur from Arsenic and Antimony Sulfides to Phosphorus Sulfides. Rational Syntheses of Several Less-Common P4Sn Species. Inorg. Chem. 1997, 36 (12): 2641–2646. doi:10.1021/ic9614881.
- ^ Nowottnick, H.; Blachnik, R. Zwei neue Phosphorsulfide (Two New Phosphorus Sulfides). Zeitschrift für anorganische und allgemeine Chemie. 1999, 625 (12): 1966–1968. doi:10.1002/(SICI)1521-3749(199912)625:12<1966::AID-ZAAC1966>3.0.CO;2-B.
- ^ 6.0 6.1 6.2 6.3 6.4 Catherine E. Housecroft; Alan G. Sharpe. Chapter 15: The group 15 elements. Inorganic Chemistry, 3rd Edition. Pearson. 2008: 484. ISBN 978-0-13-175553-6.
- ^ "Phosphorus trisulfide" in Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 563.
- ^ "Phosphorus pentasulfide" in Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 565.
- ^ A. Earnshaw; Norman Greenwood. Phosphorus. Chemistry of the elements, 2nd edition. Butterworth Heinemann. 2002: 508. ISBN 0750633654.
- ^ 10.0 10.1 R. Bruce King. Phosphorus. Encyclopedia of Inorganic Chemistry, 2nd edition. Wiley. 2005: 3711. ISBN 9780470862100.
- ^ "Phosphorus heptasulfide" in Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 566.
- ^ "Diphosphorus pentasulfide" in Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 567.
