原子理論

原子理論(英語:atomic theory)又稱原子說[1]、原子論,是物理學與化學中有關物質本質的科學理論,其主張物質是由一個個離散單元——原子——所構成,與物質無限可分的概念相反。
原子起初是自然哲學中的概念。西方對於原子的稱呼來自於古希臘語:ἄτομος,拉丁語:atomus(意為:uncut,indivisible;不可分割的)[2]。而中文中,原子早前的譯名「莫破」[3]:p.15也來源於此 。原子這一概念由於與基督教教義牴觸一度被棄置[4]:p.8,直到近代才被重拾。
18世紀末,在化學領域裡,人們發現物質在化學變化過程中一系列可確切描述的規律。這為原子理論成為一個科學理論提供了實驗依據。19世紀初,道耳吞提出了他的原子理論來解釋化學中的現象。而有關原子是否真實存在的爭論,直到20世紀初愛因斯坦從分子運動論角度解釋布朗運動,並得到實驗驗證後,才真正得到肯定答案。
19世紀末至20世紀初,物理學家通過一系列與電磁學和放射性有關的實驗發現,原本認為「不可分割」的原子實際上是由一系列的次原子粒子(主要有電子、質子和中子)構成的,而這些粒子可以各自獨立存在。由於原子被發現是可分的,物理學家隨即引入了一個新術語「基本粒子」以描述原子各個組分。20世紀上半葉,伴隨著對於原子結構認識的深入以及物理學界的量子革命,現代原子理論模型被逐步建立起來。
哲學
[編輯]古代
[編輯]自然哲學中的原子論在許多文化中都有記述。中國的墨子曾提出物質分割到一定程度就不能再分割下去了[5]。而在西方,關於原子的哲學概念可以追溯至古希臘的哲學家,如德謨克利特、留基伯、伊壁鳩魯[6] 。古印度也存在原子論者,如耆那教開創者大雄[7] 。而古希臘的和古印度的原子論之間的關係,是各自獨立出現還是彼此間有影響,仍存在爭議[8] 。
原子論者認為世界是由兩個基本部分,原子和虛空,組成。原子不可破壞且不會變化,並且存在有無數種具有不同形狀和大小的原子。它們在虛空中運動,互相碰撞。有時多個原子可能會形成一個集群,而宏觀世界物質的多樣性來源於集群內部原子的種類及排列方式的不同。[9][2]
概念的重拾
[編輯]古希臘哲學中的原子概念由於其與基督教中認為上帝是肉體和靈魂的創造者的理念相抵而被棄置數個世紀。期間偶有恢復原子論的嘗試,但都在教會的高壓下失敗[4]:p.8。15世紀初,古希臘原子論著作殘片被發現,被義大利學者帶回義大利傳抄,於15世紀下半葉出版,並於17世紀被譯成法語、英語廣為流傳。「原子」作為一個自然哲學概念,在皮埃爾·伽桑狄、弗朗西斯·培根、羅伯特·波以耳、伽利略·伽利萊等人的努力下得以重拾。[10]
艾薩克·牛頓是一個原子論者,並將原子這一概念引入他的科學研究。他對於質量給出定義,提出了物質組成粒子說、光的微粒說以及質點和質點系等理論模型,這都與他對於原子論的信仰有關。牛頓將原子論運用於科學研究,這也是後世科學研究中對於原子論利用的發端。[10]
18世紀,羅傑·博什科維奇基於牛頓的粒子說和力的概念以及萊布尼茨的單子論提出了他的原子論。他提出了原子間的交互作用力與它們間距離的波動關係,並提出了交互作用力的數學模型。博斯科維克的原子論被後世廣泛運用,例如對於構成化合物的粒子為何能被分開的解釋。[10]
近代理論
[編輯]原子-分子學說
[編輯]
18世紀末,在沒有涉及原子理論的概念條件下,在化學領域,發現了兩條有關化學反應的規律:
這兩條規律為原子理論成為一個科學理論提供了實驗依據[4]:p.10。
約翰·道耳吞基於牛頓的原子論[10]在他1808年發表的《化學哲學的新體系》中提出了他的原子理論[4]:p.10:
- 所有的化學元素都是由一種非常小的粒子組成,即原子,這些粒子無法藉由化學方法進一步的分割。
- 同種元素的原子具有相同的大小,質量和性質。不同元素的原子是不同的,即元素性質由組成它們的原子決定。
- 如果兩種元素能形成多於一種化合物,在一種元素的質量一定時,各種化合物中的第二種元素質量的比例會是一個簡單整數比,即倍比定律[13]。
道耳吞根據他的原子理論,依據元素在化合物中質量比,以氫元素的質量為基準,來估計它們的原子量。但他存在一些與現今公認事實不相符的概念:1.將元素的單質視為由元素的原子構成。2.兩種元素間形成的最簡單的化合物分子是由每種元素的一個原子構成(所以他認為水的分子式是HO,而非H2O)。[14] 另外,他進行實驗所使用的儀器很粗陋。這些因素造成他所得到的測量結果與現在的公認值有一定的偏差。例如,1803年,他認為氧原子的質量是氫原子的5.5倍,因為他對於水做測量發現每得到1g的氫會得到5.5g的氧,並堅信水的分子式是HO。1806年,他又將氧的原子量修正為7。而如果依據水現在公認的分子式,氧原子和氫原子的質量比則為16:1。[15]
1811年,阿莫迪歐·亞佛加厥從原理上對於道耳吞的理論進行了修正。亞佛加厥提出分子是決定物質性質的最小微元,分子是由原子構成的[4]:p.12。亞佛加厥所做出的修正劃清了分子和原子概念間的區別,並與道耳吞的原子理論形成了解釋物質微觀構成的原子—分子學說。
道耳吞的原子理論並沒有涉及到原子本身結構的討論。有關原子本身結構的現代原子理論模型,直到基本粒子被發現以及量子的概念被引入後才被逐步建立。[16]:p.242
反原子論
[編輯]分子運動論的驗證
[編輯]由於分子和原子本身難以觀測,19世紀,許多物理學家對於原子本身存在與否表示質疑,如恩斯特·馬赫和威廉·奧斯特瓦爾德。[17][3]
1821年,約翰·赫帕斯提出了氣體的內能與氣體分子的動能有關係[4]:p.17。隨後,奧古斯特·卡爾·克羅尼格、魯道夫·克勞修斯、詹姆斯·克拉克·馬克士威、路德維希·波茲曼等人發展了分子運動論。這一理論從假設氣體是由不斷碰撞彼此或器壁的原子構成的出發,解釋了氣體的宏觀性質,如壓力、比熱、粘性。而分子運動論為支持原子真實存在提供了理論支持。[4]:p.8
1827年,英國植物學家羅伯特·布朗觀察到飄浮在水中花粉迸出之微粒(並非花粉本身)會不停地做表面上無規則的運動,即布朗運動。1905年5月,阿爾伯特·愛因斯坦發表了《熱的分子運動論所要求的靜液體中懸浮粒子的運動》,從分子運動論的角度,將布朗運動歸因於水分子對於花粉迸出之微粒不停的撞擊,並構造了一個數學假想模型去描述它[18]。這個數學模型於1908年得到了法國物理學家讓·佩蘭的實驗驗證,使有關原子是否真正存在的爭論結束[17]:p.iv。而對於原子理論的實驗驗證也是讓·佩蘭1926年獲得諾貝爾物理學獎原因之一。
現代模型
[編輯]次原子粒子的發現
[編輯]在約瑟夫·湯木生1897年通過對於陰極射線的研究發現電子前,原子一直被認為是物質的最基本組分[19]。
克魯克斯管是內部裝有兩個由真空隔開的電極的密封玻璃容器,當在電極間加上電壓時,會產生陰極射線。這種射線會在打在玻璃管另一端時形成一個光點。湯木生通過實驗發現這種射線除了在磁場中會發生偏折(這一點當時已知),在電場中同樣會發生偏折。通過這一點,他得出這種射線不是一種光,而是一種帶有負電的、非常輕的的粒子構成的粒子流。他將這種粒子稱為「微粒」("corpuscles")。這種粒子後來被科學家通常稱為「電子」。[16]:p.212-213
湯木生提出原子是可分的,而微粒是其組分[16]:p.213。為了解釋原子整體的電中性,他提出了葡萄乾布丁模型,即「微粒」像布丁中的葡萄乾一樣嵌在原子中(儘管在湯木生的模型中它們並非靜止的),而正電荷在原子中均勻分布[20]。
原子核的發現
[編輯]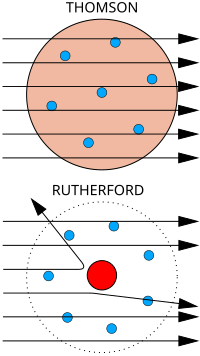
上圖: 預期結果:α粒子在穿過原子時運動軌跡不會發生明顯偏折。
下圖:觀測結果:少數(儘管極少)粒子感受到集中在原子核的正電荷影響,它們的運動軌跡因此發生大角度的偏折。
1909年,約瑟夫·湯木生的學生,歐尼斯特·拉塞福對於葡萄乾布丁模型提出了反對意見。他發現一個原子的正電荷和絕大部分的質量都集中於其整體體積中一個極小的部分,而他猜想,集中的位置是原子的正中心。
在金箔實驗中,漢斯·蓋革和歐尼斯特·馬斯登在拉塞福指導下利用α粒子轟擊一片金箔,並用螢光屏觀測它們運動軌跡的偏折情況[21] 。如果電子質量非常小,α粒子動量非常大,而正電荷在原子中像葡萄乾布丁模型中假定的那樣均勻分布,那麼在實驗中,所有的α粒子在通過金箔時運動軌跡都不會產生明顯的偏折。而令他們驚訝的是,少數α粒子的運動軌跡發生了大角度偏折。因而,可以證實原子的絕大部分質量都集中在其中一個微元中(即「原子核」)。但還不能對這一個微元的電性做出定論,其可以是電中性的,也可以不是。通過庫侖定律可以得到,當α粒子經過電中性的質點附近時,運動軌跡並不會發生偏折;但如果這個質點帶正電的話,就會發生偏折。而拉塞福分析,實驗的結果證明後者是正確的。[16]:p.214
拉塞福基於試驗的結果提出了原子的行星模型。在這一模型中,電子像「行星」那樣環繞在一個體積極小的、集中原子所有正電的原子核周圍,因為只有正電荷集中分布才足以產生導致α粒子運動軌跡發生大角度偏折的電場[22]。
同位素的發現
[編輯]1913年,放射化學家弗雷德里克·索迪在對放射性衰變產物進行實驗研究時,發現在元素週期表的同一個格內可能包含有不止一個元素[23]。隨後瑪格麗特·托德創造了「同位素」這一術語來稱呼具有這樣關係的元素。
同年,約瑟夫·湯木生進行了一個實驗。實驗中他令氖離子流傳過電磁場,最終打在一個感光板上。在感光版上有兩個光斑,而這意味著存在兩種不同的偏轉軌跡。湯木生將其歸結為氖離子流中包含有不同質量的氖離子[24] 。而不同氖離子間會存在質量差異這一現象在1932年中子被發現後得到了解釋。
核子的發現
[編輯]1917年,拉塞福用α粒子轟擊氮氣,並觀察到氣體中放射出氫核(拉塞福會注意到這一點,是因為此前他在用α粒子轟擊氫氣時在產物中也發現了氫核)。拉塞福提出放出的氫核來自於氮核(實際上,他分裂了氮核)[25]。
而從他自己及他的學生波耳和亨利·莫斯利的研究工作中,他得知任何一種原子內部的總正電荷總是氫核所帶電荷的整數倍。同時,當時測定的許多元素的原子量依據普勞特假定都近似等於氫的原子量整數倍。由此可以看出氫原子是最輕的原子。由此,他總結道,氫核是一種單一粒子並且是所有原子核的一種基本組分。他將這種粒子命名為質子。而通過進一步的實驗,拉塞福發現絕大多數的原子的質量要比其中包含的質子的總質量大得多,他推測多出的質量來源於當時尚未發現的一種電中性的粒子,並將其暫稱為「中子」。[16]:p.303
1928年,瓦爾特·博特在用α粒子轟擊鈹時,發現產生了一種具有高穿透性,且電中性的射線。隨後發現這種射線照射石蠟時,可以放射出質子。起初,它被認為是高能γ射線,因為γ射線可以類似地將金屬中電子轟出。但詹姆斯·查兌克發現,如果它是一種電磁輻射,那麼在至少滿足能量和動量守恆條件下,它的游離作用過於強勁。1932年,查兌克用這種射線照射幾種元素的單質,如氫氣、氮氣,通過測量反衝的帶電粒子所帶能量,他推斷這種射線實際上是由一種電中性的粒子構成;這種粒子並不像γ射線那樣靜質量為零,而是具有與質子相似的質量。由此,他提出這種粒子就是拉塞福所預測存在的「中子」。[16]:p.304[26]而由於發現了中子,1935年,他獲得了諾貝爾物理學獎。
量子概念的初步引入
[編輯]原子的行星模型有兩個明顯缺陷:
- 電子是帶電的,這一點與環繞恆星的行星不同。而依據古典電動力學中的拉莫爾方程式,速度不斷變化的電荷會發射出電磁波,在這過程中電荷會逐漸散失能量,而行星模型中電子在軌域上運行會發生這一過程,從而螺旋式地靠近原子核,最終在極短時間內撞擊原子核。
- 它並不能解釋實驗觀測得到的原子的發射光譜及吸收光譜中為何會呈現為幾個離散峰值的譜線。在古典物理學中,能量是連續變化的,因而光譜應該是連續的。[16]:p.214[27]:p.24
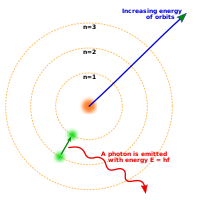
20世紀初,量子論引起物理學的一場革命。「量子」這一概念最早由馬克斯·普朗克引入,用以解釋黑體輻射;他提出,能量並非像古典力學中那樣連續變化,而是以一個個各自離散的單元,即能量的量子形式發射或吸收。1905年,阿爾伯特·愛因斯坦將這一概念引入到光學,成功解釋了光電效應。1913年,尼爾斯·波耳引用這一概念建立了原子的波耳模型。在波耳模型中,電子只能在一系列特定的的軌域上運動,其能量以及角動量也具有一系列特定的、離散的數值,而其軌域半徑與它具有的能量成比例[28]。這模型禁止電子發生螺旋式靠近原子核的情形,因為它不能連續性地失去或獲得能量,只能在不同能階間做瞬時躍遷[28]。在發生躍遷時,會發射或吸收具有對應能量的光子[28]。同時,這個模型也為氫原子光譜提供了理論解釋。[27]:p.47
波耳模型存在一定的理論缺陷:它只能解釋氫原子的光譜,對於多電子原子的光譜的解釋並不成功。隨著分光成象技術進一步完善,氫光譜亦出現了波耳模型所不能解釋的譜線。1916年,阿諾·索末菲將波耳模型中電子的圓軌域推廣為橢圓軌域來解釋氫光譜新出現的譜線,但這令模型變得複雜、難以應用,並且仍不能用在多電子原子的情形中。[27]:p.58-60
量子化的模型
[編輯]
1924年,路易·德布羅意提出所有運動的粒子(特別是像電子這樣的次原子粒子)在一定程度上具有波的特徵。受到這一想法的啟發,埃爾溫·薛丁格開始探究電子的運動行為:以波的形式去表述,是否會比以粒子的形式表述更為貼切。而在1926年所發表的薛丁格方程式裏[29],他將電子以波函數的方式去描述,而不再將其表述為點粒子。這種表述方法解釋了許多波耳模型所不能解釋的現象。儘管波函數的概念在數學上非常簡潔,但是它的物理圖像是難以想像的,因而在當時遭遇到一些反對意見[30]。馬克斯·玻恩提出波函數描述的不是電子自身的狀態,而是它所有可能的狀態,因而可用於計算電子在核周圍某一位置出現的機率[31] 。這調和了兩種對立的描述電子方式,將它描述為波還是將它描述為粒子,並由此引入了波粒二象性理論。這一理論提出電子既具有波的屬性,比如它可以發生繞射;又具有粒子的屬性,比如它有質量[32]。
而將電子以波函數描述的一個後果就是,從數學上無法同時給出一個電子的位置和動量,即維爾納·海森堡於1927年發表的不確定性原理[33]。根據波耳模型,電子具有簡潔、並可以完全確定的軌域,這論點不兼容於不確定性原理,至此,波耳模型迅速被新理論淘汰。原子的現代模型根據電子在某一位置出現的機率來描述一個原子內電子可能出現的位置。一個電子可以在距核任意距離的位置被發現,但取決於其所處能階,它會在一個特定的區域出現得特別頻繁,這一位置稱為它所處的軌域。不同軌域可能具有不同形狀,例如球形、啞鈴形或環形等等,但都以原子核為中心[34]。
相關條目
[編輯]參考資料
[編輯]- ^ https://terms.naer.edu.tw/detail/e56e4dd29c53837ad6881bd07760f0d5/?startswith=zh&seq=6
- ^ 2.0 2.1 Berryman, Sylvia, "Ancient Atomism (頁面存檔備份,存於網際網路檔案館)", The Stanford Encyclopedia of Philosophy (Fall 2008 Edition), Edward N. Zalta (ed.)
- ^ 3.0 3.1 趙凱華; 羅蔚茵. 《新概念物理教程 热学》第二版. 高等教育出版社. ISBN 9787040066777.
- ^ 4.0 4.1 4.2 4.3 4.4 4.5 4.6 Wolfgang Demtröder. Atoms, Molecules, and Photons An Introduction to Atomic-, molecular- and Quantum Physics Second Edition. Springer. ISBN 9783642102974.
- ^ 《墨子·經說下》「非:斫半,進前取也,前則中無為半,猶端也。前後取則「端中」也。斫必半,「無」與「非半」,不可斫也。」今譯:將一個物體切成兩半,取前一半,將前一半再切成兩半,仍取其前半,一直取到不能再分,猶如一個點。前半和後半分取,就一定在點與點間。如果分割方式是半分,「無」和「不能半分的」,是不可以分割的。
- ^ The atomists, Leucippus and Democritus: fragments, a text and translation with a commentary by C.C.W. Taylor, University of Toronto Press Incorporated 1999, ISBN 978-0-8020-4390-0, pp. 157-158.
- ^ Thomas McEvilley, The Shape of Ancient Thought: Comparative Studies in Greek and Indian Philosophies ISBN 978-1-58115-203-6, Allwarth Press, 2002, p. 317-321.
- ^ Teresi, Dick. Lost Discoveries: The Ancient Roots of Modern Science. Simon & Schuster. 2003: 213–214. ISBN 0-7432-4379-X.
- ^ Aristotle, Metaphysics I, 4, 985b 10–15.
- ^ 10.0 10.1 10.2 10.3 閻康年. 《微觀物質組成理論的發展與近現代科學》.中國科學院自然科學史研究所
- ^ Weisstein, Eric W. Lavoisier, Antoine (1743-1794). scienceworld.wolfram.com. [2009-08-01]. (原始內容存檔於2013-04-07).
- ^ Proust, Joseph Louis. "Researches on Copper (頁面存檔備份,存於網際網路檔案館)", excerpted from Ann. chim. 32, 26-54 (1799) [翻譯複製自Henry M. Leicester and Herbert S. Klickstein, A Source Book in Chemistry, 1400–1900 (Cambridge, Massachusetts: Harvard, 1952)]. 2007年8月29日檢索
- ^ Andrew G. van Melsen. From Atomos to Atom. Mineola, N.Y.: Dover Publications. 1952. ISBN 0-486-49584-1.
- ^ Johnson, Chris. Avogadro - his contribution to chemistry. [2009-08-01]. (原始內容存檔於2009-06-27).
- ^ Alan J. Rocke. Chemical Atomism in the Nineteenth Century. Columbus: Ohio State University Press. 1984.
- ^ 16.0 16.1 16.2 16.3 16.4 16.5 16.6 趙凱華; 羅蔚茵. 《新概念物理教程 量子物理》第一版. 高等教育出版社. ISBN 7040088347.
- ^ 17.0 17.1 阿爾伯特·愛因斯坦(編譯者:許良英等). 《爱因斯坦文集》第二卷. 商務印書館. ISBN 9787100067676.
- ^ Einstein, A. Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen. Annalen der Physik. 1905, 322 (8): 549. Bibcode:1905AnP...322..549E. doi:10.1002/andp.19053220806.
- ^ Thomson, J.J. Cathode rays ([facsimile from Stephen Wright, Classical Scientific Papers, Physics (Mills and Boon, 1964)]). Philosophical Magazine. 1897, 44 (269): 293 [2014-04-06]. doi:10.1080/14786449708621070. (原始內容存檔於2015-08-12).
- ^ Thomson, J.J. On the Structure of the Atom: an Investigation of the Stability and Periods of Oscillation of a number of Corpuscles arranged at equal intervals around the Circumference of a Circle; with Application of the Results to the Theory of Atomic Structure. Philosophical Magazine. 1904, 7 (39): 237 [2014-04-06]. doi:10.1080/14786440409463107. (原始內容存檔於2018-01-19).
- ^ Geiger, H. The Scattering of the α-Particles by Matter. Proceedings of the Royal Society. 1910, A 83: 492–504 [2014-04-06]. (原始內容存檔於2017-12-18).
- ^ Rutherford, Ernest. The Scattering of α and β Particles by Matter and the Structure of the Atom (PDF). Philosophical Magazine. 1911, 21 (4): 669 [2014-04-06]. Bibcode:2012PMag...92..379R. doi:10.1080/14786435.2011.617037. (原始內容存檔 (PDF)於2019-05-15).
- ^ Frederick Soddy, The Nobel Prize in Chemistry 1921. Nobel Foundation. [2008-01-18]. (原始內容存檔於2008-04-09).
- ^ Thomson, J.J. Rays of positive electricity. Proceedings of the Royal Society. 1913, A 89 (607): 1–20 [2014-04-06]. Bibcode:1913RSPSA..89....1T. doi:10.1098/rspa.1913.0057. (原始內容存檔於2019-03-08). [as excerpted in Henry A. Boorse & Lloyd Motz, The World of the Atom, Vol. 1 (New York: Basic Books, 1966)]. Retrieved on August 29, 2007.
- ^ Rutherford, Ernest. Collisions of alpha Particles with Light Atoms. IV. An Anomalous Effect in Nitrogen. Philosophical Magazine. 1919, 37 (222): 581 [2014-04-06]. doi:10.1080/14786440608635919. (原始內容存檔於2010-06-07).
- ^ Chadwick, James. Possible Existence of a Neutron (PDF). Nature. 1932, 129 (3252): 312 [2014-04-06]. Bibcode:1932Natur.129Q.312C. doi:10.1038/129312a0. (原始內容存檔 (PDF)於2018-08-27).
- ^ 27.0 27.1 27.2 楊福家. 《原子物理学》第四版. 高等教育出版社. ISBN 9787040229943.
- ^ 28.0 28.1 28.2 Bohr, Niels. On the constitution of atoms and molecules (PDF). Philosophical Magazine. 1913, 26 (153): 476–502 [2014-04-06]. doi:10.1080/14786441308634993. (原始內容存檔 (PDF)於2017-08-09).
- ^ Schrödinger, Erwin. Quantisation as an Eigenvalue Problem. Annalen der Physik. 1926, 81 (18): 109–139. Bibcode:1926AnP...386..109S. doi:10.1002/andp.19263861802.
- ^ Mahanti, Subodh. Erwin Schrödinger: The Founder of Quantum Wave Mechanics. [2009-08-01]. (原始內容存檔於2009-04-17).
- ^ Mahanti, Subodh. Max Born: Founder of Lattice Dynamics. [2009-08-01]. (原始內容存檔於2009-01-22).
- ^ Greiner, Walter. Quantum Mechanics: An Introduction. [2010-06-14]. (原始內容存檔於2020-07-30).
- ^ Heisenberg, W. Über den anschaulichen Inhalt der quantentheoretischen Kinematik und Mechanik. Zeitschrift für Physik. 1927, 43 (3–4): 172–198. Bibcode:1927ZPhy...43..172H. doi:10.1007/BF01397280.
- ^ Milton Orchin, Roger Macomber, Allan Pinhas, R. Wilson. The Vocabulary and Concepts of Organic Chemistry, Second Edition (PDF). [2010-06-14]. (原始內容存檔 (PDF)於2018-10-08).
延伸閱讀
[編輯]- Bernard Pullman (1998) The Atom in the History of Human Thought, trans. by Axel Reisinger. Oxford Univ. Press.
- Eric Scerri (2007) The Periodic Table, Its Story and Its Significance, Oxford University Press, New York.
- Charles Adolphe Wurtz (1881) The Atomic Theory, D. Appleton and Company, New York.
外部連結
[編輯]- Atomism(頁面存檔備份,存於網際網路檔案館) by S. Mark Cohen.
- Atomic Theory(頁面存檔備份,存於網際網路檔案館) - detailed information on atomic theory with respect to electrons and electricity.


