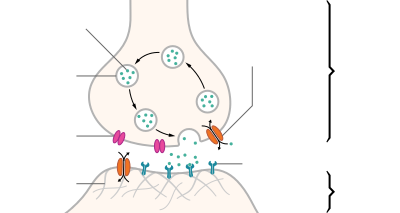
突觸修剪
突觸修剪包括軸突和樹突的完全退化和消失,是在包括人類在內的許多哺乳動物的幼年期至進入青春期之間發生的突觸消除過程。[1]修剪從出生時開始,一直持續到25歲左右。 [2] 傳統上認為,突觸修剪在性成熟時完成,但這一觀點受到核磁共振成像研究的挑戰 。 [3] 嬰兒大腦的尺寸到成年時將增長至原來的5倍,最終達到約860( ± 80)億個神經元 。 [4] 導致這一增長的因素有兩個:神經元之間的突觸連接的增長,以及神經纖維的髓鞘形成 。不過,神經元的總數保持不變。[5]修剪受環境因素影響,被普巴認為表徵了學習 。 青春期之後,突觸連接的體積由於突觸修剪再次減少。
類型
[編輯]調節性修剪
[編輯]出生時,視覺和運動皮層中的神經元與上丘,脊髓和腦橋相連。每個皮層中的神經元被選擇性修剪,保留與功能合適的處理中心的連接。因此,視覺皮層中的神經元修剪與脊髓中神經元的突觸,運動皮層切斷與上丘的連接。這種修剪的類型的稱作大規模定型軸突修剪。神經元將長的軸突分支送到合適和不適的目標區域,而不合適的連接最終被修剪掉。 [6]
退行性事件優化了神經發生中連接的冗餘性,從而建立了特定而成熟的迴路。凋亡和修剪是切斷不需要的連接的兩種主要方式。 在凋亡的過程中,神經元被殺死並且與這個神經元相關的所有連接也被一併消除。相比之下,神經元並不會在修剪過程中死亡,而是需要從功能上不合適的突觸連接中把軸突收縮回來 。
人們認為,突觸修剪的目的是從大腦中去除不必要的神經元結構。隨著人類大腦的發展,了解更複雜的結構的需求變得更加重要,而在童年時期形成的較為簡單的聯繫要被複雜的結構代替。[7]
儘管修剪具有調節童年認知發展的幾個含義,修剪還被認為是去除可能已經損壞或退化的神經元的過程,以便進一步改善特定腦區的「聯通」能力。[7]此外,已經證實這一機制不僅在發育和修複方面起作用,而且還是一種通過根據神經元的突觸效率移除神經元,持續維持有效大腦機能的方式。
成長中的大腦的修剪
[編輯]與學習相關的修剪被稱為小規模軸突末端分支修剪。軸突向目標區域內的神經元延伸短的軸突末端分支。特定的末端分支由於競爭被修剪。對末端分支的修剪選擇遵循在常見於突觸可塑性中的「用進廢退」原則。這意味著經常使用的突觸具有強的連接,而很少使用的突觸則被移除。 在脊椎動物中常見的例子包括,修剪外周神經系統中神經肌肉接點的軸突末端,以及修剪到中樞神經系統中小腦的攀緣纖維的輸入。 [6]
在人類方面,可以通過推測兒童和成人之間膠質細胞和神經元的估計數量的差異,觀察到突觸修剪,這在視丘背內側核中很大差異。
在2007年牛津大學的一項研究中,研究人員根據大小和體視學分合法收集的證據得到的估值,比較了8個新生兒和8個成年人的大腦。 他們表明,平均而言,在他們所測量的視丘背內側核區域,成人神經元數量的估值比新生兒低41%。 [8]
然而,就神經膠質細胞而言,成年人的估計值遠遠大於新生兒。成人大腦平均有3630萬,而新生兒樣本中這個數字為1060萬。[8]人們認為,大腦的結構會在出生之後的發生退化和去傳入時發生變化,儘管在某些研究中沒有觀察到這些現象。 在發育時,由於程序性細胞死亡而處於喪失過程中的神經元不太可能被重新使用,而是會被新的神經結構或突觸結構所替代,這一已被發現皮層下灰質的結構變化同時發生。
突觸修剪與老年時期發生的退行性事件分屬兩類。發育中的修剪是與經歷相關的,而與老年同義的連接退化卻並非如此。定型修剪可以被比作將石頭斧鑿雕刻成雕像的過程。雕像完成之後,天氣開始風化侵蝕雕像,則表現了與經歷無關的連接刪除。
修剪學習中的遺忘問題
[編輯]所有嘗試建造通過修剪廢棄的連接來學習的人工智慧系統都有一個問題,即每次學習新知識時,就會忘記之前學到的一切 。 由於生物大腦和人工智慧想所有物體一樣遵循相同的物理定律,因此這些研究者認為,如果生物大腦是通過修剪學習的,那它們會面臨同樣的災難性遺忘問題。 如果認為學習是發展過程的一部分,那這就是一個尤為嚴重的問題,因為對於發展型學習而言,保有之前的知識是必要的,因此有觀點認為,突觸修剪不能成為智力發展的一個機制。有人認為,發展型學習必定採用了突觸修剪以外的機制。 [9] [10]
為繁殖節省能量和不連續的差異
[編輯]一種關於為什麼人或許多其他靈長類動物大腦在成長時會發生突觸修剪的理論認為,維持突觸會消耗身體其他部位成長和性成熟過程中可能需要的營養。該理論假設突觸修剪沒有任何心理功能。根據實驗觀察,人腦可分為兩類,一類在成長過程中使突觸密度降低約41%,而另一類是突觸幼態延續型,其中很少甚至沒有突觸密度的降低,但兩者之間沒有連續體。按照該理論的解釋,這是具有不同營養需求的生理適應,其中一種類型需要釋放營養以度過青春期,而另一種則可以通過其他方式調配的營養達到性成熟,無需減少大腦的營養消耗。 該理論指出,大腦中的大部分營養消耗是用於維持腦細胞及其突觸,而不是神經發放本身。這還可以解釋這樣一個觀察:有的大腦在性成熟之後數年似乎仍在繼續修剪,這是因為它們又更強健的突觸,使其可以在突觸棘最終解體之前許多年被忽視。另一個可以解釋這種不連續性的假說是,囿於大部分人類基因組都需要缺少序列特異性的功能來避免大量有害突變,功能性的基因空間因而有限,可以預見的是,少數有較大影響的突變導致了演化的發生,而大多數突變根本沒有任何影響。 [11] [12]
機制
[編輯]解釋突觸修剪的三個模式是軸突退化,軸突收縮和軸突脫落。 在所有情況中,突觸都是由瞬時軸突末端形成的,而突觸的消除是由軸突修剪引起的。每個模式提供了不同的方法移除軸突以刪除突觸。在小規模的軸突分支修剪中,神經活動被認為是一個重要的調節因素,[來源請求]但分子機制仍不清楚。 激素和生長因子被認為是調節大規模定型軸突修剪的主要外部因素。 [6]
軸突退化
[編輯]在果蠅中,變態過程中神經系統發生了廣泛的變化。蛻皮酮引發了變態,而在此期間,神經網絡發生了大量的修剪和重組。因此,理論上果蠅的修剪是由蛻皮酮受體的激活觸發的。脊椎動物神經肌肉接點的去神經研究表明,軸突的去除機制與華勒氏變性非常相似。 [13] 但是,在果蠅中看到的整體和同時的修剪與哺乳動物神經系統的修剪不同,後者發生在局部和整個發育的多個階段。 [6]
軸突收縮
[編輯]軸突分支以從遠端到近端的方式收縮。一般認為,縮回的軸突內容物被回收到軸突的其他部分。 對於哺乳動物的中樞神經系統而言,軸突修剪中生物學機制仍不清楚。 但是修剪與小鼠中的導向分子有關。導向分子用於通過排斥來控制軸突尋路,還觸發對旺盛突觸連接的修剪。 Semaphorin配體以及其受體 neuropilin 和 plexin 可用於誘導軸突收縮,以啟動海馬-隔核和錐體下束(IPB)的修剪。 已經發現,在具有Plexin-A3缺陷的小鼠中,對海馬投射的定型修剪顯著受損。 具體來說,一旦Plexin-A3受體被3類Semaphorin配體激活,連接到瞬時靶標的軸突就會縮回。 在IPB中,出生前Sema3F的mRNA表達出現在海馬中,出生後消失並重新出現在始層。巧合的是,IPB的修剪大約在同一時間開始。在海馬-隔核投射的情況,Sema3A的mRNA表達在修剪啟動的3天後開始。這表明可檢出的mRNA表達後幾天內,配體一達到閾值蛋白水平,就會觸發修剪。[14]沿視覺皮質脊髓束(CST)的軸突修剪在neuropilin-2突變體和plexin-A3和plexin-A4雙突變小鼠中是有缺陷的。Sema3F也在修剪過程中在脊髓背側表達。在這些突變體中沒有觀察到運動CST修剪缺陷。 [6]
在形成視網膜拓撲映射時,也觀察到了對軸突過度分支的定型修剪。已發現Ephrin及其受體Eph可調節和引導視網膜軸突分支。已發現沿前-後軸的ephrin-A和EphA之間的前向信號傳導可抑制末端區後方的視網膜軸突分支形成。前向信號傳導還促進對已經到達末端區域的軸突的修剪。然而,尚不清楚IPB修剪中觀察到的收縮機制是否適用於視網膜軸突。 [15]
已經發現ephrin-B蛋白與其Eph受體酪氨酸激酶之間的反向信號傳導會引發IPB的收縮機制。觀察到ephrin-B3可傳遞酪氨酸磷酸化依賴性反向信號至海馬軸突,從而觸發多餘IPB纖維的修剪。 推測的途徑涉及EphB在靶細胞表面表達,導致ephrin-B3的酪氨酸磷酸化。隨和,ephrin-B3與胞質銜接蛋白Grb4結合,導致Dock180和p21活化激酶(PAK)募集並結合。 Dock180的結合增加了Rac-GTP水平,而PAK介導了活性Rac的下游信號傳導,從而導致軸突縮回和最終的修剪。 [16]
軸突脫落
[編輯]小鼠神經肌肉接點中回縮軸突的延時成像顯示,軸突脫落是修剪的一個可能機制。回縮軸突按從遠到近的順序運動,類似於收縮。 但是在許多時候,軸突縮回的同時伴有殘留物的脫落。 名為軸體(axosome)的殘留物中,含有與位於軸突末端的突觸小體相同的細胞器,常見於突觸小體附近。這表明軸體來源於突觸小體。此外,軸體不含有電子緻密細胞質或斷裂的粒線體,表明它們並非由沃勒變性形成。 [17]
另見
[編輯]參考文獻
[編輯]- ^ Chechik, G; Meilijson, I; Ruppin, E. Synaptic pruning in development: a computational account.. Neural Computation. 1998, 10 (7): 1759–77. CiteSeerX 10.1.1.21.2198
 . PMID 9744896. S2CID 14629275. doi:10.1162/089976698300017124.
. PMID 9744896. S2CID 14629275. doi:10.1162/089976698300017124.
- ^ Brain’s synaptic pruning continues into your 20s. New Scientist. [2018-06-19]. (原始內容存檔於2021-01-16) (美國英語).
- ^ Iglesias, J.; Eriksson, J.; Grize, F.; Tomassini, M.; Villa, A. Dynamics of pruning in simulated large-scale spiking neural networks. BioSystems. 2005, 79 (9): 11–20. PMID 15649585. doi:10.1016/j.biosystems.2004.09.016.
- ^ Azevedo, Frederico A.C.; Carvalho, Ludmila R.B.; Grinberg, Lea T.; Farfel, José Marcelo; Ferretti, Renata E.L.; Leite, Renata E.P.; Filho, Wilson Jacob; Lent, Roberto; Herculano-Houzel, Suzana. Equal numbers of neuronal and nonneuronal cells make the human brain an isometrically scaled-up primate brain. The Journal of Comparative Neurology. 2009, 513 (5): 532–41. PMID 19226510. doi:10.1002/cne.21974.
- ^ Craik, F.; Bialystok, E. Cognition through the lifespan:mechanisms of change. Trends in Cognitive Sciences. 2006, 10 (3): 131–138. CiteSeerX 10.1.1.383.9629
 . ISSN 1364-6613. PMID 16460992. S2CID 11239746. doi:10.1016/j.tics.2006.01.007.
. ISSN 1364-6613. PMID 16460992. S2CID 11239746. doi:10.1016/j.tics.2006.01.007.
- ^ 6.0 6.1 6.2 6.3 6.4 Vanderhaeghen, P.; Cheng, HJ. Guidance Molecules in Axon Pruning and Cell Death. Cold Spring Harbor Perspectives in Biology. 2010, 2 (6): 1–18. PMC 2869516
 . PMID 20516131. doi:10.1101/cshperspect.a001859.
. PMID 20516131. doi:10.1101/cshperspect.a001859.
- ^ 7.0 7.1 Chechik, Gal; Meilijison, Isaac; Ruppin, Eytan. Neuronal Regulation: a mechanism for synaptic pruning during brain maturation. Neural Computation. 1999, 11 (8): 2061–80. CiteSeerX 10.1.1.33.5048
 . PMID 10578044. S2CID 648433. doi:10.1162/089976699300016089.
. PMID 10578044. S2CID 648433. doi:10.1162/089976699300016089.
- ^ 8.0 8.1 Abitz, Damgaard; et al. Excess of neurons in the human newborn mediodorsal thalamus compared with that of the adult. Cerebral Cortex. 2007, 17 (11): 2573–2578. PMID 17218480. doi:10.1093/cercor/bhl163.
- ^ John R. Riesenberg (2000). "Catastrophic Forgetting in Neural Networks"
- ^ Gul Muhammad Khan (2017). "Evolution of Artificial Neural Development: In search of learning genes"
- ^ Stanislas Dehaene (2014). "Consciousness and the Brain: Deciphering How the Brain Codes Our Thoughts"
- ^ P. Michael Conn (2011)."Handbook of Models for Human Aging"
- ^ Low, LK.; Cheng, HJ. Axon pruning: an essential step underlying the developmental plasticity of neuronal connections. Philos Trans R Soc Lond B Biol Sci. 2006, 361 (1473): 1531–1544. PMC 1664669
 . PMID 16939973. doi:10.1098/rstb.2006.1883.
. PMID 16939973. doi:10.1098/rstb.2006.1883.
- ^ Bagri, Anil; Cheng, Hwai-Jong; Yaron, Avraham; Pleasure, Samuel J.; Tessier-Lavigne, Marc. Stereotyped Pruning of Long Hippocampal Axon Branches Triggered by Retraction Inducers of the Semaphorin Family. Cell. 2003, 113 (3): 285–299. PMID 12732138. doi:10.1016/S0092-8674(03)00267-8.
- ^ Luo, L.; Flanagan, G. Development of Continuous and Discrete Neural Maps. Neuron. 2007, 56 (2): 284–300. PMID 17964246. doi:10.1016/j.neuron.2007.10.014.
- ^ Xu, N.; Henkemeyer, M. Ephrin-B3 reverse signaling through Grb4 and cytoskeletal regulators mediates axon pruning. Nature Neuroscience. 2009, 12 (3): 268–276. PMC 2661084
 . PMID 19182796. doi:10.1038/nn.2254.
. PMID 19182796. doi:10.1038/nn.2254.
- ^ Bishop, DL.; Misgeld, T.; Walsh, MK.; Gan, WB.; Lichtman, JW. Axon Branch Removal at Developing Synapses by Axosome Shedding. Neuron. 2004, 44 (4): 651–661. PMID 15541313. doi:10.1016/j.neuron.2004.10.026.