米氏酸
| 米氏酸 | |||
|---|---|---|---|
| |||
| IUPAC名 2,2-dimethyl-1,3-dioxane-4,6-dione 2,2-二甲基-1,3-二氧六环-4,6-二酮 | |||
| 识别 | |||
| CAS号 | 2033-24-1 | ||
| ChemSpider | 15418 | ||
| SMILES |
| ||
| InChIKey | GXHFUVWIGNLZSC-UHFFFAOYAM | ||
| 性质 | |||
| 化学式 | C6H8O4 | ||
| 摩尔质量 | 144.13 g·mol−1 | ||
| 外观 | 白色针状晶体 | ||
| 熔点 | 96 °C(369 K) | ||
| pKa | 4.97 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
米氏酸(Meldrum's acid),又名Meldrum 酸、丙二酸亚异丙酯,学名2,2-二甲基-1,3-二氧六环-4,6-二酮;2,2-二甲基-1,3-二噁烷-4,6-二酮。一种白色针状晶体,易溶于有机溶剂和碱性水溶液。熔点96摄氏度。
制备[编辑]
由丙二酸、丙酮和醋酐混合物在冰水浴冷却下滴加浓硫酸催化合成。醋酐起到活化羧酸的作用。
也可用丙二酸与醋酸2-丙烯酯在酸催化下合成。
历史[编辑]
由苏格兰人米尔壮(Meldrum)于1908年合成[1]。米尔壮根据这个晶体可以溶解在碳酸氢钠溶液里的特性断定里面含有羧基。给出了下面的结构:

过了40年,这个结构被戴维森(Davidson)和博哈德(Bernhard)证明是错误的。[2] 一个正确的丙二内酯的结构被提了出来。而且米氏酸呈酸性的原因被正确地归因于活泼亚甲基的电离。又过了40年,克莱伦斯(Clarence)和波义尔(Boyle)根据X射线晶体衍射结果指出这个“酸”的稳定构象是船式构象,并将原因归结为酯官能团为了维持平面结构的结果。[3] 阿内特随即指出这个酸在互变异构平衡溶液里烯醇式含量微乎其微。[4]
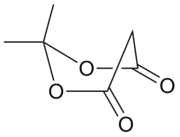
酸性之谜[编辑]
米氏酸是最容易电离的1,3-二羰基化合物。其 pKa 低达4.97,与普通羧酸相仿。米氏酸超乎寻常的高酸性在过去100年始终没有得到一个彻底完美的解释,也因此成为理论有机化学中的一个著名难题。
最早的解释是基于偶极分析。阿恩特后来提出了基于立体电子效应的解释。阿恩特指出,普通的酯由于烷氧原子上的两个孤对电子与羰基存在两种可能的共轭:一个是与羰基π键最低空轨道的共轭;一个是与羰基σ键反键轨道的共轭。这两种共轭可以降低分子能量,是分子处于更稳定的状态,所以普通酯基态的优势构象是Z式(见下图)。由于环的存在,米氏酸的内酯结构迫使两半酯处于E式,这样就阻止了孤对电子与羰基σ键反键轨道的共轭作用,其结果是羰基的亲电性增强从而能更有效地稳定α-碳负离子。由于是两半酯共同作用于一个亚甲基,相当于两倍的效果,所以米氏酸比普通内酯的酸性还要高很多。

这个解释能比较好的解释米氏酸的高酸度,但是后来的能量衡算发现这个解释只解释了50%的原因,尚有剩下50%解释不了。在2001年和2004年有人分别用量子化学对这个酸做了不同的计算,从更多的角度提出了解释。但迄今为止这个问题仍然有很大的探讨空间。
应用[编辑]
米氏酸在有机合成上有着广泛的应用。由于极易烯醇化,所以作为一个很好的亲核试剂参与诸多反应。在很多丙二酸二酯反应效果不好的场合能很好的参与反应。

参考文献[编辑]
- ^ Meldrum, Andrew Norman. A β-lactonic acid from acetone and malonic acid. Journal of the Chemical Society, Transactions. 1908, 93: 598 – 601. doi:10.1039/CT9089300598.
- ^ Davidson, David; Bernhard, Sidney A. The Structure of Meldrum's Supposed β-Lactonic Acid. Journal of the American Chemical Society. 1948, 70 (10): 3426 – 3428. doi:10.1021/ja01190a060.
- ^ Clarence E. Pfluger and Paul D. Boyle. Conformation and intermolecular interactions of Meldrum's acid: an X-ray structural investigation of 2,2-dimethyl-1,3-dioxane-4,6-dione. Journal of the Chemical Society, Transactions II. 1985: 1547 – 1549. doi:10.1039/P29850001547.
- ^ Arnett, E. M.and Harrelson, J. A. Gazz. Chim. Ital. 1987, 117: 237. 缺少或
|title=为空 (帮助)


