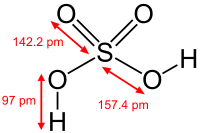
硫酸
| 硫酸 | |
|---|---|
| |

| |

| |
| IUPAC名 Sulfuric acid | |
| 别名 | 硫鏹水 |
| 识别 | |
| CAS号 | 7664-93-9 |
| ChemSpider | 1086 |
| SMILES |
|
| EINECS | 231-639-5 |
| ChEBI | 26836 |
| RTECS | WS5600000 |
| KEGG | D05963 |
| 性质 | |
| 化学式 | H 2SO 4 |
| 摩尔质量 | 98.086 g·mol⁻¹ |
| 外观 | 無色液體 |
| 密度 | 1.84 g/cm3,液体[1] |
| 熔点 | 10 °C(283 K)([1]) |
| 沸点 | 337 °C(610 K)([1]) |
| 溶解性(水) | 完全混溶,放热 |
| 蒸氣壓 | 0.001 mmHg (20 °C)[2] |
| pKa | -2.8, 1.99 |
| 黏度 | 26.7 cP,20 °C |
| 结构 | |
| 晶体结构 | 單斜 |
| 空间群 | C2/c |
| 晶格常数 | a = 818.1(2) pm, b = 469.60(10) pm, c = 856.3(2) pm |
| 晶格常数 | α = 90°, β = 111.39(3) pm°, γ = 90° |
| 热力学 | |
| ΔfHm⦵298K | −814 kJ·mol−1[3] |
| S⦵298K | 157 J·mol−1·K−1[3] |
| 危险性 | |
| 欧盟危险性符号 | |
| 警示术语 | R:R21, R35, R68/21/22 |
| 安全术语 | S:S1/2, S26, S30, S45 |
| MSDS | ICSC 0362 |
| 欧盟编号 | 016-020-00-8 |
GHS危险性符号 
| |
| GHS提示词 | Danger |
| H-术语 | H314 |
| P-术语 | P260, P264, P280, P301+330+331, P303+361+353, P363, P304+340, P305+351+338, P310, P321, P405, P501 |
| NFPA 704 | |
| 闪点 | 不可燃 |
| PEL | TWA 1 mg/m3[2] |
| TLV | 15 mg/m3 (IDLH), 1 mg/m3 (TWA), 2 mg/m3 (STEL) |
| 致死量或浓度: | |
LD50(中位剂量)
|
2140 mg/kg(大鼠,口服)[4] |
LC50(中位浓度)
|
50 mg/m3(豚鼠,8小時) 510 mg/m3(大鼠,2小時) 320 mg/m3(小鼠,2小時) 18 mg/m3 (豚鼠)[4] |
LCLo(最低)
|
87 mg/m3(豚鼠,2.75小時)[4] |
| 相关物质 | |
| 相关化合物 | 硒酸 盐酸 硝酸 鉻酸 |
| 相关化学品 | 亞硫酸 过一硫酸 三氧化硫 發煙硫酸 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
硫酸(英語:Sulphuric acid)是一种具有高腐蚀性的無機強酸,化学式為H
2SO
4,被稱為化學工業之母[5]。一般為透明至微黄色,在任何浓度下都能与水混溶并且放热[6]。有时在工业製造过程中,硫酸也可能被染成暗褐色以提高人们对它的警惕性。[7]
作為二元酸的硫酸在不同浓度下有不同的特性,而其对不同物质,如金属、生物组织、甚至岩石等的腐蚀性,都归根于它的强酸性,以及它在高浓度下的强烈脱水性(化学性质)、吸水性(物理性质)与氧化性。高浓度硫酸能对皮肉造成极大的伤害,因为它除了会透过酸性水解反应分解蛋白质及脂肪造成化学烧伤外,还会与碳水化合物发生脱水反应并造成二级火焰性灼伤,將有機化合物脫水成碳(C)[8][9];若不慎滴入眼中,更会破坏视网膜造成永久失明。故在使用时,应做足安全措施。另外,硫酸的吸水性可以用来干燥非碱性气体 。
不同特性的有着不同的应用,如家用强酸通渠剂[10][11]、铅酸蓄电池的电解质、肥料、炼油厂材料及化学合成剂等。
歷史[编辑]
硫酸发现于公元8世纪。阿拉伯炼丹家贾比尔通过乾馏硫酸亚铁晶体得到硫酸。

一些早期对化学有研究的人,如拉齐、贾比尔等,还写了有关硫酸及与其相关的矿物质的分类名单;其他一些人,如伊本·西那医师,则较為重视硫酸的种类以及它们在医学上的价值。[12]
在17世纪,德国化学家约翰·格劳勃将硫与硝酸钾混合蒸汽加热製出硫酸,在这过程中,硝酸钾分解并氧化硫令其成為能与水混合并变為硫酸的三氧化硫(SO
3),於是,在1736年,伦敦药剂师Joshua Ward用此方法开拓大规模的硫酸生產。
在1746年,John Roebuck则运用这个原则,开创铅室法,以更低成本有效地大量生產硫酸。经过多番的改良后,这个方法在工业上已被採用了将近两个世纪。[3]由John Roebuck创造的这个生產硫酸的方法能製造出浓度為65%的硫酸,后来,法国化学家约瑟夫·路易·盖-吕萨克以及英国化学家John Glover将其改良,使其能製造出浓度高达78%的硫酸,可是这浓度仍不能满足一些工业上的用途。
在18世纪初,硫酸的生產都依赖以下的方法:黄铁矿(FeS
2)被燃烧成硫酸亚铁(FeSO
4),然后再被燃烧,变為能在480 °C下分解成氧化铁以及能用以製造任何浓度硫酸的三氧化硫的硫酸铁(Fe2(SO4)3)。但是,此过程的庞大成本阻碍了浓硫酸的广泛运用。[3]
后来,到了1831年,英国製醋商人Peregrine Phillips想到了接触法,能以更低成本製造出三氧化硫以及硫酸,这种方法在现今已被广泛运用。[3]
在古代中国,稀硫酸被称为“绿矾油”。在公元650~683年(唐高宗时),炼丹家孤刚子在其所著《黄帝九鼎神丹经诀》卷九中就记载着“炼石胆取精华法”,即干馏石胆(绿矾)而获得硫酸。
需要注意的是以上反应须要在强热条件下进行。
中國古代中,硫酸也有石膽精的名稱。於《格物入門》一書裏,硫酸名叫磺酸。
物理性质[编辑]
纯硫酸一般為无色黏糊液体,形态有点像油。但有时在工业生產过程中,它也有可能被染色以提高购买者对其危险性的警惕。
浓度[编辑]
儘管可以製出浓纯净的硫酸,并且室温下是稳定的(所谓的分解成恒沸物的反应发生在接近沸点的高温之下),但是纯硫酸熔点过高(283.4K/10.3℃)[13],所以为了方便运输通常制成98%硫酸,故一般所说的“高浓度硫酸”指的便是浓度為98%的硫酸。另外,硫酸在不同的浓度下有不同的应用,以下為一些常见的浓度级别:[14][15]
| 质量分数 (kg/kg) |
H2SO4密度 |
物质的量浓度 (mol/L) |
俗称 |
|---|---|---|---|
| 10% | 1.07 | ~1 | 稀硫酸 |
| 29–32% | 1.25–1.28 | 4.2–5 | 铅酸蓄电池酸 |
| 62–70% | 1.52–1.60 | 9.6–11.5 | 室酸 肥料酸 |
| 98% | 1.83 | ~18 | 浓硫酸 |
硫酸亦可被製成其他形态。例如,将高浓度的SO
3打入硫酸可製成发烟硫酸(H
2S
2O
7)。有关发烟硫酸的浓度,人们通常以SO
3的百分比作準或者是H
2SO
4的百分比作準,两者均可。一般所称的“浓发烟硫酸”的浓度為45%(含110.1% H
2SO
4)或65%(含114.6% H
2SO
4)。100%纯发烟硫酸(焦硫酸)為固体,熔点為36 °C。
硫酸也有一定的药用价值。另外在分析化学上也有很大的用途,例如,稀硫酸常用於滴定法。
极性与导电性[编辑]
纯硫酸是一种非常极性的液体,其介电係数大约為100。因為它分子与分子之间能够互相质子化对方,造成它极高的导电性,这个过程被称為自偶电离。这种反应机理是和纯磷酸以及纯氢氟酸所同出一辙的。但纯硫酸达成这种反应平衡所需要的时间则比以上两者快得多,差不多是即时性的。[16]
2H2SO4↔H3SO4++HSO4-
- Kap(25 °C)= [H
3SO+
4][HSO−
4] = 2.7×10−4
而水的相应化学平衡则比硫酸的少1010(一百亿),其Kw為10−14。
(以上只為簡化版)
雖然為黏糊液體,硫酸,正如上述,有很高的導電性,這主要歸根於H
3SO+
4及HSO−
4離子。除此,硫酸在很多化學反應裡也是非常好的溶劑。
化学性质[编辑]
水合反应与脱水反应[编辑]

硫酸与水发生的水合為高度放热反应,溶液在稀释过程中容易溅出,造成危险。故很多指引均建议实验人员将浓硫酸缓慢加入水中稀释并伴有搅拌以散热而不是将水加入浓硫酸中,一方面因为硫酸的密度比水大,把水加入硫酸中会使水浮在硫酸上面沸腾飞溅,另一方面因為这可利用水的高比热容,减低危险性。
正如其他酸,硫酸在与水混合后会释放氢离子:
- H
2SO
4 + H
2O → H
3O+
+ HSO4− K1 = 2.4×106(强酸)
- HSO4− + H
2O → H
3O+
+ SO42− K2 = 1.0×10-2 [17]
K1和K2是酸度係数。
因為硫酸与水的强亲和性及其热力学的配合,它是一种很强的脱水剂,能抽走化合物裡的水分子。在实验室,硫酸通常会被加入白糖裡(蔗糖),以展示它的这种强烈脱水性特质。由於水分子的流失,白糖最终只剩下黑色的碳(炭化),这种反应最终使整个烧杯裡的混合物变黑:
- C12H22O11(白色蔗糖) +硫酸→ 12 C(黑炭) + 11 H2O(水蒸气)
- C + 2 H2SO4 → CO2 + 2 SO2 + 2 H2O
硫酸与其他碳水化合物的脱水反应也差不多,例如,当硫酸被加入淀粉时,碳也是最终的產物。这可以充分地表现在硫酸与由纤维素构成的白纸的反应上,白纸最终被蚀穿,并呈现类似烧焦的顏色,这现象同样发生在纤维织物上,如毛巾。儘管稀硫酸的脱水性比浓硫酸的弱得多,但是稀硫酸也能对织物上的纤维素造成很大的破坏。
硫酸与碳水化合物的脱水反应,可以用以下总方程式表达:
- (C
6H
10O
5)n +硫酸→ 6n C + 5nH
2O
再者,硫酸的强烈脱水性也可反映在硫酸铜身上。原本為蓝色,含水分的硫酸铜晶体在与硫酸发生反应后,变為白色的粉末,这也是硫酸铜在脱水状况下的状态(无水硫酸铜):
- CuSO4·5H2O(蓝色晶体) +硫酸→ CuSO4(白色粉末) + 5 H2O
一般酸碱特性泛论[编辑]
硫酸正如其他的酸,能与碱发生中和反应,变為硫酸盐及水。例如,用以电镀或製成杀真菌剂的硫酸铜便是从硫酸与氧化铜的中和反应中取得:
- CuO(𝑠)+ H
2SO
4(𝑎𝑞)→ CuSO
4 (𝑎𝑞) + H
2O(𝑙)
硫酸可以和碳酸盐发生反应。如稀硫酸可以和碳酸钠反应,产生碳酸,但碳酸不稳定,会迅速分解为二氧化碳和水:
- Na
2CO
3 + H
2SO
4 → Na
2SO
4 + CO
2 + H
2O
浓硫酸加热下可以和硝酸钾反应得到硝酸、和氯化钠反应得到氯化氢(这也是实验室制取氯化氢的方法之一)[18]:
- KNO
3 + H
2SO
4 → KHSO
4 + HNO
3 - NaCl + H
2SO
4 → NaHSO
4 + HCl
硫酸是不挥发的强酸,因此可以制取弱酸和挥发性酸。以其与乙酸钠為例,它会取代乙酸(CH
3COOH)產生出硫酸氢钠:
- H
2SO
4 + CH
3COONa → NaHSO
4 + CH
3COOH
硫酸在与硝酸反应时担当酸与脱水剂的角色,產生出NO+
2离子,在有机化学裡是很重要的一个反应过程。
金属氧化与强氧化性质[编辑]
稀硫酸具有一般酸的性质,能与锌(Zn)、铁(Fe)、锰(Mn)、镍(Ni)、铝(Al)、镁(Mg)等活泼金属反应,释出氢气(H2),而不与铜等不活泼金属发生产生氢气的反应。以铁為例:
- Fe(𝑠) + H
2SO
4(𝑎𝑞)→ H
2(𝑔)+ FeSO
4(𝑎𝑞)
但浓硫酸具有强氧化性能与很多不活泼金属发生氧化还原反应。[9] 浓硫酸是强氧化剂,在反应过程中,它被还原為水及二氧化硫(SO2)而不是氢,硫的氧化数由+6降至+4。浓硫酸的强氧化性与其中存在的H2SO4分子有关。
- 2 H2SO4 (𝑐𝑜𝑛𝑐.)+ 2 e- → SO2 + 2 H2O + SO42-
以铜為例:
- Cu + 2 H2SO4 (𝑐𝑜𝑛𝑐.) →SO2 + 2 H2O + CuSO4
若与活泼金属接触则浓硫酸被还原的程度将更大,以锌為例:
- 3 Zn + 4 H2SO4 (𝑐𝑜𝑛𝑐.)→ S + 4 H2O + 3 S+3ZnSO₄
非金属物质的氧化[编辑]
浓硫酸的强氧化性使其亦可以氧化非金属,例如碳和硫。
- C + 2 H2SO4(𝑐𝑜𝑛𝑐.)→ CO2 + 2 SO2 + 2 H2O
- S + 2 H2SO4(𝑐𝑜𝑛𝑐.)→ 3 SO2 + 2 H2O
在上述反应,碳和硫的氧化数由0升至+4。
当硫、硒、碲溶于发烟硫酸时,逐步被氧化为S192+(橙红色)、S82+(深蓝色)、S42+(淡黄色)、Se82+(深绿色)、Se42+(黄色)、Te42+(紫红色)等多聚阳离子。[19]
跟某些盐反应[编辑]
硫酸可与可溶性钡盐反应生成硫酸钡沉淀和相应的酸,可与碳酸盐反应生成相应的硫酸盐、水和二氧化碳。
- H2SO4 + BaCl2 → BaSO4↓ + 2HCl
- Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2↑
亲电芳香取代反应[编辑]
自然界的存在[编辑]
地球[编辑]

100%纯硫酸為无色粘稠液体,很难在地球上找到,因為其与水的亲和性很高,一暴露在空气中便会吸取水分。酸雨可能含稀硫酸,这主要是因為在雨水的作用下,大气中的二氧化硫与水结合,当中的產物亚硫酸还会进一步地被氧化,形成硫酸。至於大气中的二氧化硫则主要来自於很多交通工具所排放的废气以及含硫化石燃料的燃烧。
自然界中,很多含硫的矿物质,例如硫酸铁,在发生氧化反应后形成硫酸,所形成的液体為高度酸性,能氧化残留的金属物,并释放出有毒的气体。
另有指在生物界,有一种海蛞蝓(Notaspidean pleurobranchs)也能喷射含硫酸的分泌物来御敌。[21]
其他星体[编辑]
金星[编辑]
硫酸也能在金星的上层大气中找到。这主要出自於太阳对二氧化硫,二氧化碳及水的光化作用。波长短於160纳米的紫外光子能光解二氧化碳,使其变為一氧化碳及原子氧。原子氧非常活跃,它与二氧化硫发生反应变為三氧化硫。三氧化硫进一步与水產生反应释出硫酸。硫酸在金星大气中较高较冷的地区為液体,这层厚厚的、离星球表面约45-70公里的硫酸云层覆盖整个星球表面。这层大气不断地释出酸雨。
在金星裡,硫酸的形成不断循环。当硫酸从大气较高较冷的区域跌至较低较热的地区时被蒸发,其含水量越来越少而其浓度也就越来越高。当温度达300 °C时,硫酸开始分解為三氧化硫以及水,这两个產物均為气体。三氧化硫非常活跃并分解為二氧化硫及原子氧,原子氧接著氧化一氧化碳令其变為二氧化碳,二氧化硫及水会从大气中层升高到上层,它们会发生反应重新释出硫酸,整个过程又再一次循环。
木卫二[编辑]
由伽利略号探测器传来的影像显示,硫酸亦有可能出现於木星的其中一个卫星——木卫二,但有关细节仍存有争议。[22]
生產[编辑]
硫酸的生產方法主要有接触法及湿硫酸法。
接触法[编辑]
- S (s) + O
2 (g)→ SO
2 (g)
接著,在催化剂五氧化二钒的作用下,二氧化硫会被氧气氧化為三氧化硫:
- 2 SO
2 (g) + O
2 (g) ⇌ 2 SO
3 (g)(催化剂為V
2O
5)
三氧化硫会被製成97–98%的H
2SO
4并进一步成為发烟硫酸(H
2S
2O
7),发烟硫酸然后被水稀释成浓硫酸:
- H
2SO
4 (l) + SO
3 (g)→ H
2S
2O
7 (l)
- H
2S
2O
7 (l) + H
2O (l)→ 2 H
2SO
4 (l)
值得注意的是,三氧化硫并不会被直接打入水,因為这高放热反应会產生出具腐蚀性的气溶胶而不是液体,气溶胶很难被分离出来,故此方法无效[來源請求]:
- SO
3 (g) + H
2O (l)→ H
2SO
4 (l)
湿硫酸法[编辑]
第一步,硫会被燃烧為二氧化硫:
- S (s) + O
2 (g)→ SO
2 (g)
或者是,硫化氢(H
2S)会被焚化為二氧化硫:
- 2 H
2S + 3 O
2 → 2 H
2O + 2 SO
2(−518 kJ/mol)
在催化剂五氧化二钒的作用下,二氧化硫会被氧气氧化為三氧化硫:
- 2 SO
2 (g) + O
2 (g)⇌ 2 SO
3 (g)(催化剂為V
2O
5)
三氧化硫会被水合為硫酸:
- SO
3 + H
2O → H
2SO
4 (g)(−101 kJ/mol)
最后一步则是将硫酸凝结為液体硫酸,浓度大约是97%到98%:
- H
2SO
4(g)→ H
2SO
4(l)(−69 kJ/mol)
其他方法[编辑]
大约在1900年之前,铅室法為生產硫酸的主要方法。[23]截至40年代末,在美国仍有50%的化工厂採用铅室法生產硫酸。
在古代的实验室裡,用亚硫酸氢钠制备二氧化硫,通入双氧水裡產生硫酸:
- SO2 + H2O2 → H2SO4
硫化氢和硫酸铜溶液反应,草酸和硫酸铜的反应(因为草酸铜Ksp过小,强行拉动反应[9],但是此方法因为反应可逆制得硫酸往往纯度很低),以及磺酰氯的水解,都会产生硫酸。电解硫酸铜溶液也可以产生稀硫酸。
但在現代,实验室通常可以直接购得硫酸而不需要制备。
用途[编辑]

硫酸是工业上一种重要的化学品,它用途十分广泛,如製造肥料、非碱性清洁剂、护肤品、以及油漆添加剂与炸药等。硫酸的重要性可以从它的生產量中反映。[24]截至2004年,全世界约出產近十八亿吨的硫酸,当中,亚洲佔35%;北美(包括墨西哥)佔24%;非洲佔11%;西欧佔10%;东欧及俄罗斯佔10%;澳大利亚及大洋洲佔7%;南美佔7%。[25]在总生產量裡,约60%用来製作肥料,如磷酸铵及硫酸銨;约有20%被化工厂用以製作清洁用品,製药或其他工业用途,如作為提炼汽油的催化剂等。[26]
一般化工用途[编辑]
硫酸最广泛的用途是製造磷酸,而磷酸则用於製造含磷肥料。93%硫酸被用於製造硫酸钙,氟化氢以及磷酸。氟化氢最终会以氢氟酸的形态隔走。
- Ca
5F(PO
4)
3 + 5 H
2SO
4 + 10 H
2O → 5 CaSO
4·2 H
2O + HF + 3 H
3PO
4
硫酸另一个用途用於造纸。硫酸会用於產生硫酸铝,硫酸铝在木浆纤维上与少量肥皂物发生反应,形成含铝羧酸盐用以使纤维物凝固,形成较坚硬的表面。
- 硫酸铝的產生:
- Al
2O
3 + 3 H
2SO
4 → Al
2(SO
4)
3 + 3 H
2O
硫酸亦可製造用於隔走废水中有害物质的氢氧化铝。氢氧化铝在污水处理厂裡是一个非常重要的化学物质。还有,硫酸也是很多染料製造中必要的化学物。
工业清洁品[编辑]
硫酸也是很多用以清洁氧化物、锈跡等的清洁品中的成分。已用的硫酸会被回收再用,方法是将酸与多种有机物燃烧,释出二氧化硫及三氧化硫,这些原材料可以用来生产新的硫酸。
催化剂[编辑]
硫酸是多种化学反应的催化剂。例如,它催化尼龙的製造过程;另外,多个汽油提炼过程也需要硫酸的催化进行。
电解质[编辑]

硫酸是汽车铅酸蓄电池中的电解质。有关的化学方程式為:
- 阳极:
- Pb + SO2-
4 ⇌ PbSO
4 + 2 e- - 阴极:
- PbO
2 + 4 H+ + SO2-
4 + 2 e- ⇌ PbSO
4 + 2 H2O - 总方程:
- Pb + PbO
2 + 4 H+ + 2 SO2-
4 ⇌ 2 PbSO
4 + 2 H2O
一般家居用途[编辑]
世界大多酸性水道疏通用品均含有硫酸,[10][11]可以除去头髮、油污等淤塞物。基於安全理由,在使用时宜小心并带上手套。另外,由於硫酸会与水发生高放热反应,在使用前宜尽量保持渠道乾爽,并慢慢倒入有关疏通剂。
危险性[编辑]
实验室风险[编辑]

硫酸(特别是在高浓度的状态下)能对皮肉造成极大伤害。正如其他具腐蚀性的强酸强碱一样,硫酸可以迅速与蛋白质及脂肪发生酰胺水解作用及酯水解作用,从而分解生物组织,造成化学性烧伤。不过,其对肉体的强腐蚀性还与它的强烈脱水性有关,因為硫酸还会与生物组织中的碳水化合物发生脱水反应并释出大量热能。除了造成化学烧伤外,还会造成二级火焰性灼伤。[8][9] 故由硫酸所造成的伤害,很多时都比其他可作比较的强酸(像盐酸及硝酸)的大。若不慎让硫酸接触到眼睛的话,视网膜会受到严重破坏而可能会造成永久性失明;而若不慎误服,则会对体内器官构成不可逆的伤害,甚至会致命。[6]浓硫酸也具备很强的氧化性,会腐蚀大部分金属,故需小心存放。[9]
随著浓度的增加,硫酸的危险性也会增加。这是因為除了酸性物质的比例在加大外,其脱水性及氧化性亦在上升。当一溶液的硫酸含量等同或超过1.5 M时,就应贴上“腐蚀性”警告标示,而在0.5—1.5 M之间的,则為“刺激性”。但是,即便在实验室惯用的“低浓度”硫酸(浓度大约為1 M,10%比重)在一定时间也会蚀穿纸张。
当浓硫酸不慎接触到皮肤时,为了避免浓硫酸进一步伤害皮肤,应第一时间用大量流动的清水冲洗患处至少10—15分鐘,因為大量的水能够迅速冷却受损组织并带走热量。旧时教科书认为,应用乾布将皮肤上的浓硫酸擦去再作进一步的处理,但是由于高浓度硫酸接触皮肤后会迅速将皮肉炭化,用乾布可能会将已受损的皮肤擦破。而若硫酸意外地溅到保护衣物,应立即将其脱下,并彻底地冲洗有关部位。[27]
由於硫酸和水会发生剧烈的反应并释出热能,当稀释浓硫酸时,应把酸倒入水中而不是把水倒入酸中,这样可以利用水的高比热容,减低因高温沸腾使酸溅出的风险。一般在实验室中,稀释6 M(约35%比重)或浓度更高的硫酸是最為危险的,因為这个分量的硫酸在与水发生反应时,能释出足够的热量使整杯溶液沸腾。
工业风险[编辑]
虽然硫酸并不是易燃,但当与金属发生反应后会释出易燃的氢气,有可能导致爆炸,而作為强氧化剂的浓硫酸与金属进行氧化还原反应时会释出有毒的二氧化硫,威胁工作人员的健康。另外,长时间暴露在带有硫酸成分的浮质中(特别是高浓度),会使呼吸管道受到严重的刺激,更可导致肺水肿。但风险会因暴露时间的缩短而减少。
在美国,硫酸的最多可接触分量(PEL)被定為1 mg/m3,此数字在其他国家相若。误服硫酸有机会导致维生素B12缺乏症,其中,脊椎是最易受影响的部位。
相關[编辑]
参考资料[编辑]
- ^ 1.0 1.1 1.2 Haynes, William M. CRC Handbook of Chemistry and Physics 95. CRC Press. 2014: 4–92 [18 November 2018]. ISBN 9781482208689 (英语).
- ^ 2.0 2.1 NIOSH Pocket Guide to Chemical Hazards. #0577. NIOSH.
- ^ 3.0 3.1 3.2 3.3 3.4 Zumdahl, Steven S. Chemical Principles 6th Ed.. Houghton Mifflin Company. 2009: A23. ISBN 0-618-94690-X.
- ^ 4.0 4.1 4.2 Sulfuric acid. Immediately Dangerous to Life and Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ [1]
- ^ 6.0 6.1 Sulfuric acid safety data sheet (PDF). (原始内容 (PDF)存档于2012-06-17) (英语).
Clear to turbid oily odorless liquid, colorless to slightly yellow.
- ^ Sulfuric acid. (原始内容存档于2012-06-03) (英语).
Colorless (pure) to dark brown, oily, dense liquid with acrid odor.
- ^ 8.0 8.1 BASF Chemical Emergency Medical Guidelines - Sulfuric acid (H2SO4) (PDF). BASF Chemical Company. 2012 [2014-12-18] (英语).
- ^ 9.0 9.1 9.2 9.3 9.4 Sulfuric acid – uses. (原始内容存档于2013-05-09) (英语).
- ^ 10.0 10.1 How to use sulfuric acid (sulphuric acid) for drain cleaning. (原始内容存档于2013-10-28) (英语).
Many drain cleaners on the market use sulfuric acid to eat away at clogs.
- ^ 11.0 11.1 Sulphuric acid drain cleaner (PDF). herchem.com. (原始内容 (PDF)存档于2013-10-29) (英语).
- ^ Vladimir Karpenko, John A. Norris (2001), Vitriol in the history of Chemistry (页面存档备份,存于互联网档案馆), Charles University in Prague
- ^ 《无机化学》,高等教育出版社,第四版下册P503
- ^ The Columbia Encyclopedia 6th. 2008 [2010-03-16]. (原始内容存档于2009-07-11) (英语).
|contribution=被忽略 (帮助) - ^ Encyclopædia Britannica 26 11th: 65–69. 1910–1911.
|contribution=被忽略 (帮助) - ^ 16.0 16.1 Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- ^ Ionization Constants of Inorganic Acids. .chemistry.msu.edu. [2011-05-30]. (原始内容存档于2011-07-20).
- ^ 《无机化学》第四版。高等教育出版社.P313
- ^ 《中级无机化学选论》.朱文祥主编。高等教育出版社。第一章酸碱理论与非水溶液化学. 1.2.8超酸
- ^ F. A. Carey. Reactions of Arenes. Electrophilic Aromatic Substitution. On-Line Learning Center for Organic Chemistry. University of Calgary. [2008-01-27]. (原始内容存档于2008年2月26日).
- ^ [2] (页面存档备份,存于互联网档案馆) 。
- ^ Orlando, T. M.; McCord, T. B.; Grieves, G. A. The chemical nature of Europa surface material and the relation to a subsurface ocean. Icarus. 2005, 177 (2): 528–533. Bibcode:2005Icar..177..528O. doi:10.1016/j.icarus.2005.05.009.
- ^ Jones, Edward M. Chamber Process Manufacture of Sulfuric Acid. Industrial and Engineering Chemistry. 1950, 42 (11): 2208–2210. doi:10.1021/ie50491a016.
- ^ Chenier, Philip J. Survey of Industrial Chemistry. New York: John Wiley & Sons. 1987: 45–57. ISBN 0-471-01077-4.
- ^ Davenport, William George and King, Matthew J. Sulfuric acid manufacture: analysis, control and optimization. Elsevier. 2006: 8, 13 [2011-12-23]. ISBN 978-0-08-044428-4. (原始内容存档于2013-05-27).
- ^ Greenwood, Norman Neill; Earnshaw, Alan. Chemistry of the elements. 2016: 653. ISBN 978-0-7506-3365-9. OCLC 1040112384 (英语).
- ^ 说说我自大学至今十二年化学之路遭遇的安全事故. 工作虐我千百遍,我待工作如初恋. 天地出版社. 2015. ISBN 9787545511000.
不管是浓硫酸还是发烟硫酸,如果只有几滴滴到了手上的话,正确处置办法就是用最快的时间用大量水冲!……在车间工作服上溅到大量浓硫酸的处置是立马把衣服全都脱了,内衣内裤都脱,然后光着用水管子冲身子!如果大量浓硫酸(95%)以上,大量的直接溅到大面积的皮肤上,你身边有什么无毒的液体就赶紧冲,水也行,乙醇也行,食用油也行。
| ||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||






