脂多糖

脂多醣(英語:Lipopolysaccharide,缩写: LPS)是由一種脂質和一種多醣組成的大分子,是細菌毒素。它們由含O-抗原、外核、內核組成,均以共價鍵連接,存在於細菌荚膜中,即革蘭氏陰性細菌(如大腸桿菌和沙門氏菌)細胞膜的最外層。 如今,內毒素 (英語:endotoxin)一詞通常與脂多醣同義,[1] 但也有一些內毒素(原意是指細菌細胞內的毒素,在細胞解體時釋放出來)與脂多醣無關,如苏云金芽孢杆菌產生的所謂delta endotoxin蛋白[2]。
脂多醣對人體健康產生重大影響,主要是透過與免疫系統的相互作用。 [3]在嚴重的情況下,脂多醣會導致敗血性休克。[4] 在較低水平和較長時期內,有證據表明脂多醣可在自體免疫、肥胖、憂鬱和细胞衰老中發揮重要的有害作用。
發現過程
[编辑]LPS的毒性是由李察•菲佛首次發現的,並認為是被細菌釋放到周圍環境中的內毒素,平常保存在細菌細胞內,僅在破壞細菌細胞壁後才會被釋放[5]:84。隨後的研究表明,從革蘭氏陰性微生物中釋放LPS,不一定需要破壞細菌細胞壁,反而LPS可作為膜小泡運輸正常生理活動的一部分,以OMVs形式分泌出來,包含着其他致病因子和蛋白質[6]。如今,內毒素通常與LPS同義[7],不過仍有一些與LPS不相關的內毒素,例如革蘭氏陽性的蘇雲金芽孢桿菌所分泌的bt毒蛋白。
結構
[编辑]
脂多糖通常由三部分组成:
- 多糖鏈,又稱多聚O抗原鏈(O polysaccharide) ,是細菌菌體抗原的抗原決定簇。由多個寡糖重復單位組成。 通常由1至6個糖殘基重復單位構成,具有很高的可變性,僅在大腸桿菌中就有170多種不同的多糖鏈已被報道[8][9]。但多糖鏈並不存在於所有的革蘭氏陰性菌中,其在某些革蘭氏陰性菌中是缺乏的,如腦膜炎雙球菌和博德氏菌屬。這種不存在多糖鏈的脂多糖有時也被叫做脂寡糖[10]。多糖鏈存在與否決定LPS是粗糙或光滑,標準長度的多糖鏈會使LPS光滑,而缺少或減少多糖鏈則會使LPS變得粗糙[11]。具有粗糙LPS的細菌通常具有比疏水性抗生素更滲透的細胞膜,因為粗糙LPS更具疏水性[12]。
- 核心多糖,在結構上分為內核心寡糖和外核心寡糖,其中內核心寡糖由3個KDO結構和3個庚醣結構組成[13][14]。許多細菌的LPS核心多糖還包含非碳水化合物成分,例如磷酸鹽、氨基酸和乙醇胺取代基等。綠膿桿菌在革蘭氏陰性菌中具有最磷酸化的內核心寡糖:LD-Hep残基HepI被3個磷酸殘基和1個PEtN修飾,而另一個LD-Hep残基HepII則被3個磷酸殘基和1個氨基甲酰基(Cm)修飾[15]。
- 脂質A,是細菌內毒素活性的根源,並且幫助脂多糖分子錨定在外膜上[16]。與多糖鏈不同,脂質A和核心寡糖是具有LPS的革蘭氏陰性菌均會存在的結構。絕大多數脂質A是由一個葡萄糖胺二糖構成的。其中大腸桿菌的脂質A在第1和4位點被磷酸化;在2和2位點各有一條脂肪酰鏈;在3和3位點上各有一條酯鏈,並且在二糖骨幹上的2和3的主酯鏈上會再次酯化,連接一條次級脂肪酸鏈。這種結構通常在革蘭氏陰性菌中,只會在各脂肪酸鏈所在的二糖主骨幹的位點上會有所差異。脂質A可被宿主血清中的LPS結合蛋白(LBP)探查到。這依賴於分化輔助因子14(CD14)和骨髓分化因子2(MD2),然後被調理素受體CD14識別,形成一個三元復合物。隨後這個復合物激活Toll樣受體4(TLR4),從而引發信號級聯反應,導致細胞因子和凝血因子的產生,以及CAMPs和其他刺激性分子的分泌。CAMPs會通過與帶負電的脂質A磷酸基團結合來幫助確定入侵的病原體,最終導致細胞的裂解和死亡[15]。
脂寡糖
[编辑]脂寡糖(Lipooligosaccharides,LOS)是脂多糖的相對不常見結構。LOS是在某些類型的革蘭氏陰性細菌外膜中發現的醣脂,例如奈瑟菌屬和嗜血桿菌屬。該術語與細菌LPS的低分子量形式同義[17]。LOS在維持革蘭氏陰性細菌外膜的完整性和功能性方面起著核心作用。脂寡糖在某些細菌感染的發病機理中起著重要的作用。因為它們能夠充當免疫調節劑[17]。此外,LOS分子負責一些細菌菌株展示其分子擬態和抗原變異的能力,有助逃避宿主的免疫防禦系統,從而提升細菌菌株的病毒性。 脂寡糖缺乏多糖鏈,僅具有基於脂質A的外膜錨定部分和寡糖核心[18]。在腦膜炎雙球菌的情況下,分子的脂質A部分具有對稱結構,內核心寡糖由KDO和庚糖部分組成,而外核心寡糖則取決於細菌的分型[17][18]。脂寡糖是指細菌中脂多醣的低分子量形式,可分為兩種形式:高分子量形式(Mr或平滑)具有高分子量、重複多糖O鏈,而低分子量形式(低Mr或粗糙)則缺少O鏈,但有短的寡糖取代其位置[17]。
功能
[编辑]細菌方面
[编辑]脂多糖是大多數革蘭氏陰性細菌胞膜的主要成分,為細菌的結構完整性做出了巨大貢獻,正因為革蘭氏陰性菌的外膜有大量脂多糖分子,才使得其細胞膜具有獨特的難滲透性,有效幫助細菌细胞應對外界有害刺激,使胞膜免受某些化學攻擊。此外,脂多糖還增加了細胞膜的負電荷,並有助於穩定整個胞膜的結構。 這對於許多革蘭氏陰性細菌至關重要,然而脂多糖在某些革蘭氏陰性細菌中並無巨大重要性,例如腦膜炎雙球菌、卡他莫拉菌和鮑氏不動桿菌[19]。LPS會引起動物免疫系統的強烈反應。 它還涉及細菌生態學的非致病性方面,包括表面粘附現象、噬菌體敏感性以及與天敵的相互作用。 脂多糖是構建Pla活性必需的東西,然而平滑的脂多糖在空間上會阻礙到Pla。
對感染革蘭氏陰性細菌宿主的生物影響
[编辑]免疫反應
[编辑]LPS是典型的內毒素,因為它在許多細胞類型中,尤其是在單核細胞、樹突狀細胞、巨噬細胞和B細胞中結合了CD14 / TLR4 / 髓樣分化蛋白2受體複合物,從而促進促炎性細胞因子、一氧化氮和類花生酸的分泌[20]。作為細胞應激反應的一部分,超氧化物是在各種細胞類型中被誘導的主要活性氧之一,當中會表達類鐸受體。同時,LPS也是外源的熱原(即導致發燒的物質) 。這對於革蘭氏陰性細菌至關重要,因為這些分子成為新的抗微生物剂劑的候選靶標[21]。此外,LPS對許多轉錄因子的激活作用是一直處於實驗研究狀態的議題。 LPS還會產生與敗血性休克有關的多種介體。人類對LPS的敏感性比其他動物高。1μg/ kg的劑量就會令人類休克,但是小鼠最多可以耐受比其多一千倍的劑量[22]。這可能與兩個物種之間循環天然抗體 (circulating natural antibodies) 水平的差異有關[23][24]。
生物合成過程
[编辑]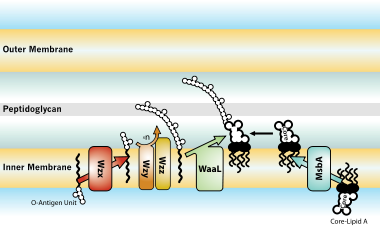
O抗原的生物合成已知有三種途徑。第一是Wzy依賴途徑,第二是ABC轉運蛋白依賴途徑,而第三則是合成酶依賴途徑。前兩個途徑很常見,而合成酶依賴途徑則不常見,然而三通路有類似的起始反應:形成十一異戊二烯焦磷酸(Und-PP)並連接糖,通常由WecA和GlcNAc-1P轉運酶催化,形成Und-PP-GlcNAc[15]。
在Wzy依賴途徑中,O抗原亞基通過Wzx翻轉酶,跨越內膜來移位至外周胞質中,再通過Wzy進行聚合,並由Wzz調節最終的O抗原鏈長度接著通過WaaL進行連接。接著再通過MsbA形成完整的和已移位的Core-Lipid A分子[25]。在ABC轉運蛋白依賴途徑中,整個O抗原是在細胞質中組裝的,然後由Wzm和Wzt組成的ABC轉運蛋白轉運出去。Wzm形成膜通道,而Wzt提供了轉運能量[15]。在合成酶依賴途徑中,依賴兩種酶WbbE和WbbF,同時通過內膜延長並排出O抗原[15]。
運輸過程
[编辑]
透過將細胞內已裝配完整的LPS正確裝配到外膜,使得與脂多糖相關的阻滲、有機溶劑耐受性、疏水性抗生素耐受性及膜通透性等功能得以實現。該運輸系統的作用主要依賴7個不同的脂多糖運輸蛋白 (LptABCDEFG) 協同完成。整個系統貫穿細菌內膜至外膜,並且由ABC轉運體復合物LptB2FG、胞質內協同轉運蛋白LptA和LptC,以及外膜蛋白復合物LptDE共同構成。
首先,細胞內膜上蛋白復合物共同形成ABC轉運體復合物,接收由MsbA翻轉酶翻轉出內膜的完整脂多糖結構[27]。LPS翻轉出內膜的細胞周質面後,會被呈遞給ABC轉運體的LptB2FG,構建出一個針對LPS的信號轉導通路,並且將LPS運輸至周質轉運蛋白LptA/C。因本身攜帶有大量的負電荷而會對鄰近的分子間產生靜電排斥力的脂質A,使得LPS能沿LptA-LptC進行單向移動。接著,LPS會通過LptA與LptD間的水溶性周質結構,被運輸至位於外膜的β桶狀蛋白LptD的氮端,並且插入LptD的内部。在LptD的碳端桶狀蛋白結構中,由LptD的分子伴侶LptE進行方向調整,使其垂直於外膜,並且在外膜帶正電荷的Mg2+的幫助下完成在LptD蛋白中的側向移動過程。最終,LPS成功裝配到外膜上[28][29]。
修飾
[编辑]通過修飾LPS,可以呈現特定的糖結構。這些可以被能夠抑制LPS毒素的LPS識別,抑或被使用這些糖結構,添加更多特定糖的糖基轉移酶識別。有研究顯示,腸中的一種鹼性磷酸酶可以通過去除LPS中碳水化合物上的兩個磷酸基團,使LPS解毒[30] 。這可能是一種適應機制,可幫助宿主管理小腸中革蘭氏陰性細菌的潛在毒性。當LPS進入動物組織或在動物組織中產生時,其他酶可能會幫助LPS解毒。中性粒細胞、巨噬細胞和樹突狀細胞產生脂酶,而酰氧基酰基水解酶(AOAH)則通過從脂質A中去除兩條二級酰基鏈令LPS失活。如果在胃腸外給予LPS,缺乏酰氧基酰基水解酶的小鼠就會產生高滴度的非特異性抗體,延長肝腫大和經歷很長的內毒素耐受性。胃腸外的LPS暴露後,動物可能需要失活LPS來恢復體內平衡[31]。
對健康的影響
[编辑]一般來說,脂多糖對健康的影響是由於其作為免疫系統的強效活化劑和調節劑的能力,特別是其誘發發炎的能力。
內毒素血症
[编辑]內毒素血症是由血中細菌或病灶內細菌釋放出大量內毒素至血液或向血液中輸入大量內毒素污染的液體而引起的一種病理表現[32],大約有9%的內毒素血症患者會發生多器官功能衰竭等症狀,全球的內毒素血症發生率以每年1.5%的速度增長。
腸源性內毒素血症 (IETM) ,尤其是在宿主-病原體界面的內毒素血症,被認為是酒精性肝炎發展的重要因素。這可能是由於小腸細菌過度生長,以及肝炎引起的腸道通透性增加[33],腸道革蘭陰性菌產生的內毒素容易進入循環系統,過量的內毒素隨著腸肝循環進入到肝臟[34]。
隨著細菌在血液中繁殖,還可以在病程的後期,觀察到明顯的補體激活[35]。高細菌增殖引發破壞性的內皮損傷也可能導致瀰漫性血管內凝血(DIC)。由於血液供應受損,某些內部器官(例如腎臟,腎上腺和肺)的功能會喪失。皮膚有顯示出血管損傷的作用,通常伴有瘀點、紫癜和瘀斑形式的凝血因子耗竭。肢體也可能受到一定的影響,有時會造成毀滅性的後果,例如因壞疽的形成而需要截肢[35]。而腎上腺的功能喪失會導致腎上腺功能不全,腎上腺的額外出血會導致沃特豪斯-弗里德里克森二氏症候群,兩者均可能危及生命。
脂質A可能導致哺乳動物免疫系統不受控制的激活,並且產生多種炎性介質,從而可能導致敗血性休克[18]。這種炎症反應是由Toll樣受體4介導的[18],後者是心臟及血管細胞膜上革蘭氏陰性菌的脂多糖的近端受體,其下端激活蛋白包括p38絲裂原活化蛋白激酶 (p38MAPK)、氨基末端激酶 (JNK) 和胞外信號調節激酶 (ERK) 等,負責免疫系統細胞的活化。這些炎性介質對血管內皮層的損害,可以導致毛細血管滲漏綜合徵 (capillary leak syndrome) 、血管擴張和心臟功能下降[35]。
研究表明,促炎性細胞因子如腫瘤壞死因子-α (TNF-α) 和白細胞介素-1β (IL-1β) 的過度釋放可能是內毒素血症導致心功能障礙的主要原因[36]。IL-1β 和TNF-α 均能引起血壓降低和休克,導致濃度依賴型的心肌細胞收縮性抑制,這兩種因子有可能通過協同作用,引起與內毒素血症有關聯的心肌抑制[37]。內毒素血症患者的組織損傷和多器官損傷與細胞內線粒體的功能紊亂有密不可分的聯繫[38]。內毒素血症時,TNF-α受體激活線粒體凋亡信號,在線粒體損傷初期,線粒體磷脂雙分子層膜的滲透性改變,呈持久的高通透性狀態,一些離子內流使得線粒體膜電位異常,引致破裂。最終導致線粒體凋亡,造成心肌細胞能量供應不足,進而導致心肌細胞缺失,引起心功能障礙[39]。嚴重的內毒素血症和敗血性休克與細胞內鈣離子穩態的變化有關,通常伴隨著收縮期細胞內鈣離子濃度的減少和心肌收縮的減弱。
與肥胖的關係
[编辑]有研究表明,內毒素負荷增加是某些與肥胖有關的患者群體的致病原因,內毒素負荷增加是由於腸道內產生內毒素的細菌數量增加所致[40][41][42] 。其他研究表明,從大腸桿菌中純化出的內毒素在註射入無菌模式生物後,可以誘導肥胖和胰島素的抵抗[43]。最近的一項研究發現,陰溝腸桿菌B29對人類患者的肥胖和胰島素抵抗具有潛在的作用[44] 。內毒素與肥胖症相關聯的推測機制是內毒素誘導炎症介導的途徑。埃希氏菌屬和腸桿菌屬是與內毒素相關的肥胖影響有關的細菌屬。
作為污染物在生物技術和研究中的作用
[编辑]脂多醣是細菌製備的质粒DNA或細菌表現的蛋白質中常見的污染物,必須從DNA或蛋白質中移除,以避免污染實驗,並避免工业发酵產品產生毒性[45]。
卵清蛋白經常受到內毒素的污染。卵清蛋白是動物模型中被廣泛研究的蛋白質之一,也是氣道高反應性(AHR)的成熟模型過敏原。受脂多醣污染的市售卵清蛋白可能會偽造研究結果,因為它不能準確反映蛋白質抗原對動物生理學的影響[46]。
在藥品生產過程中,有必要清除藥品容器中的所有微量內毒素,因為即使是微量的內毒素也會導致人體患病。為此需要使用去熱原烘箱 (depyrogenation oven)。要完全分解脂多醣,溫度必須超過300 °C [47]。
參見
[编辑]参考文獻
[编辑]- ^ Rietschel ET, Kirikae T, Schade FU, Mamat U, Schmidt G, Loppnow H, et al. Bacterial endotoxin: molecular relationships of structure to activity and function. FASEB Journal. February 1994, 8 (2): 217–225. PMID 8119492. S2CID 28156137. doi:10.1096/fasebj.8.2.8119492
 .
.
- ^ Höfte H, de Greve H, Seurinck J, Jansens S, Mahillon J, Ampe C, et al. Structural and functional analysis of a cloned delta endotoxin of Bacillus thuringiensis berliner 1715. European Journal of Biochemistry. December 1986, 161 (2): 273–280. PMID 3023091. doi:10.1111/j.1432-1033.1986.tb10443.x
 .
.
- ^ Roth J, Blatteis CM. Mechanisms of fever production and lysis: lessons from experimental LPS fever. Comprehensive Physiology. October 2014, 4 (4): 1563–1604. ISBN 978-0-470-65071-4. PMID 25428854. doi:10.1002/cphy.c130033.
- ^ Dellinger RP, Levy MM, Rhodes A, Annane D, Gerlach H, Opal SM, et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Critical Care Medicine. February 2013, 41 (2): 580–637. PMID 23353941. S2CID 34855187. doi:10.1097/CCM.0b013e31827e83af
 .
.
- ^ Parija SC. Textbook of Microbiology & Immunology. India: Elsevier. Jan 1, 2009 [2019-11-02]. ISBN 978-8131221631. (原始内容存档于2016-12-03).
- ^ Kulp A, Kuehn MJ. Biological functions and biogenesis of secreted bacterial outer membrane vesicles. Annu. Rev. Microbiol. 2010, 64: 163–84. PMC 3525469
 . PMID 20825345. doi:10.1146/annurev.micro.091208.073413.
. PMID 20825345. doi:10.1146/annurev.micro.091208.073413.
- ^ Rietschel ET, Kirikae T, Schade FU, Mamat U, Schmidt G, Loppnow H, Ulmer AJ, Zähringer U, Seydel U, Di Padova F. Bacterial endotoxin: molecular relationships of structure to activity and function. FASEB J. 1994, 8 (2): 217–25. PMID 8119492. doi:10.1096/fasebj.8.2.8119492. (原始内容存档于2013-11-25).
- ^ Whitfield, C; Trent, MS. Biosynthesis and export of bacterial lipopolysaccharides.. Annual review of biochemistry. 2014, 83: 99–128 [2019-11-01]. PMID 24580642. doi:10.1146/annurev-biochem-060713-035600.
- ^ Raetz, CR; Whitfield, C. Lipopolysaccharide endotoxins.. Annual review of biochemistry. 2002, 71: 635–700 [2019-11-01]. PMID 12045108. doi:10.1146/annurev.biochem.71.110601.135414.
- ^ Liu, B; Knirel, YA; Feng, L; Perepelov, AV; Senchenkova, SN; Reeves, PR; Wang, L. Structural diversity in Salmonella O antigens and its genetic basis.. FEMS microbiology reviews. 2014-01, 38 (1): 56–89. PMID 23848592. doi:10.1111/1574-6976.12034.
- ^ Rittig MG, Kaufmann A, Robins A, Shaw B, Sprenger H, Gemsa D, Foulongne V, Rouot B, Dornand J. Smooth and rough lipopolysaccharide phenotypes of Brucella induce different intracellular trafficking and cytokine/chemokine release in human monocytes. J. Leukoc. Biol. 2003, 74 (6): 1045–55. PMID 12960272. doi:10.1189/jlb.0103015.
- ^ Tsujimoto H, Gotoh N, Nishino T. Diffusion of macrolide antibiotics through the outer membrane of Moraxella catarrhalis. J. Infect. Chemother. 1999, 5 (4): 196–200. PMID 11810516. doi:10.1007/s101560050034.
- ^ Hershberger C, Binkley SB. Chemistry and metabolism of 3-deoxy-D-mannooctulosonic acid. I. Stereochemical determination. J. Biol. Chem. 1968, 243 (7): 1578–84. PMID 4296687.[失效連結]
- ^ Li, H; Yang, T; Liao, T; Debowski, AW; Nilsson, HO; Haslam, SM; Dell, A; Stubbs, KA; Marshall, BJ; Benghezal, M. Insights from the redefinition of Helicobacter pylori lipopolysaccharide O-antigen and core-oligosaccharide domains.. Microbial cell (Graz, Austria). 2017-04-25, 4 (5): 175–178. PMID 28685143. doi:10.15698/mic2017.05.574.
- ^ 15.0 15.1 15.2 15.3 15.4 羅敏菱. 幽門螺桿菌的脂多糖結構和生物合成. 心理醫生. 2016, 23 (17): 233–239 [2019-11-03].
- ^ Tzeng YL, Datta A, Kolli VK, Carlson RW, Stephens DS. Endotoxin of Neisseria meningitidis composed only of intact lipid A: inactivation of the meningococcal 3-deoxy-D-manno-octulosonic acid transferase. J. Bacteriol. May 2002, 184 (9): 2379–88. PMC 134985
 . PMID 11948150. doi:10.1128/JB.184.9.2379-2388.2002.
. PMID 11948150. doi:10.1128/JB.184.9.2379-2388.2002.
- ^ 17.0 17.1 17.2 17.3 Moran AP, Prendergast MM, Appelmelk BJ. Molecular mimicry of host structures by bacterial lipopolysaccharides and its contribution to disease. FEMS Immunol. Med. Microbiol. 1996, 16 (2): 105–15. PMID 8988391. doi:10.1016/s0928-8244(96)00072-7. (原始内容存档于2016-09-23).
- ^ 18.0 18.1 18.2 18.3 Kilár A, Dörnyei Á, Kocsis B. Structural characterization of bacterial lipopolysaccharides with mass spectrometry and on- and off-line separation techniques. Mass Spectrom Rev. 2013, 32 (2): 90–117. Bibcode:2013MSRv...32...90K. PMID 23165926. doi:10.1002/mas.21352.
- ^ Zhang G, Meredith TC, Kahne D. On the essentiality of lipopolysaccharide to Gram-negative bacteria. Curr. Opin. Microbiol. 2013, 16 (6): 779–785. PMC 3974409
 . PMID 24148302. doi:10.1016/j.mib.2013.09.007.
. PMID 24148302. doi:10.1016/j.mib.2013.09.007.
- ^ Abbas, Abul. Basic Immunology. Elsevier. 2006. ISBN 978-1-4160-2974-8.
- ^ Stewart I, Schluter PJ, Shaw GR. Cyanobacterial lipopolysaccharides and human health - a review. Environ Health. 2006, 5: 7. PMC 1489932
 . PMID 16563160. doi:10.1186/1476-069X-5-7.
. PMID 16563160. doi:10.1186/1476-069X-5-7.
- ^ Warren HS, Fitting C, Hoff E, Adib-Conquy M, Beasley-Topliffe L, Tesini B, Liang X, Valentine C, Hellman J, Hayden D, Cavaillon JM. Resilience to bacterial infection: difference between species could be due to proteins in serum. J. Infect. Dis. 2010, 201 (2): 223–32. PMC 2798011
 . PMID 20001600. doi:10.1086/649557.
. PMID 20001600. doi:10.1086/649557.
- ^ Reid RR, Prodeus AP, Khan W, Hsu T, Rosen FS, Carroll MC. Endotoxin shock in antibody-deficient mice: unraveling the role of natural antibody and complement in the clearance of lipopolysaccharide. J. Immunol. 1997, 159 (2): 970–5. PMID 9218618.
- ^ Boes M, Prodeus AP, Schmidt T, Carroll MC, Chen J. A critical role of natural immunoglobulin M in immediate defense against systemic bacterial infection. J. Exp. Med. 1998, 188 (12): 2381–6. PMC 2212438
 . PMID 9858525. doi:10.1084/jem.188.12.2381.
. PMID 9858525. doi:10.1084/jem.188.12.2381.
- ^ Wang X, Quinn PJ. Lipopolysaccharide: Biosynthetic pathway and structure modification. Prog. Lipid Res. 2010, 49 (2): 97–107. PMID 19815028. doi:10.1016/j.plipres.2009.06.002.
- ^ Ruiz N, Kahne D, Silhavy TJ. Transport of lipopolysaccharide across the cell envelope: the long road of discovery. Nat. Rev. Microbiol. 2009, 7 (9): 677–83. PMC 2790178
 . PMID 19633680. doi:10.1038/nrmicro2184.
. PMID 19633680. doi:10.1038/nrmicro2184.
- ^ May, JM; Sherman, DJ; Simpson, BW; Ruiz, N; Kahne, D. Lipopolysaccharide transport to the cell surface: periplasmic transport and assembly into the outer membrane.. Philosophical transactions of the Royal Society of London. Series B, Biological sciences. 2015-10-05, 370 (1679). PMID 26370939. doi:10.1098/rstb.2015.0027.
- ^ Schwalm, J; Mahoney, TF; Soltes, GR; Silhavy, TJ. Role for Skp in LptD assembly in Escherichia coli.. Journal of bacteriology. 2013-08, 195 (16): 3734–42 [2019-11-02]. PMID 23772069. doi:10.1128/JB.00431-13.
- ^ Putker, F; Bos, MP; Tommassen, J. Transport of lipopolysaccharide to the Gram-negative bacterial cell surface.. FEMS microbiology reviews. 2015-11, 39 (6): 985–1002. PMID 26038291. doi:10.1093/femsre/fuv026.
- ^ Bates JM, Akerlund J, Mittge E, Guillemin K. Intestinal alkaline phosphatase detoxifies lipopolysaccharide and prevents inflammation in zebrafish in response to the gut microbiota. Cell Host Microbe. 2007, 2 (6): 371–82. PMC 2730374
 . PMID 18078689. doi:10.1016/j.chom.2007.10.010.
. PMID 18078689. doi:10.1016/j.chom.2007.10.010.
- ^ Munford R, Lu M, Varley AW. Kill the Bacteria...and Also Their Messengers? 103. 2009: 29–48. ISBN 9780123748324. PMC 2812913
 . PMID 19755182. doi:10.1016/S0065-2776(09)03002-8.
. PMID 19755182. doi:10.1016/S0065-2776(09)03002-8. |journal=被忽略 (帮助) - ^ Opal SM. Endotoxins and other sepsis triggers. Contributions to Nephrology 167. 2010: 14–24. ISBN 978-3-8055-9484-4. PMID 20519895. doi:10.1159/000315915.
|journal=被忽略 (帮助) - ^ Parlesak A, Schäfer C, Schütz T, Bode JC, Bode C. Increased intestinal permeability to macromolecules and endotoxemia in patients with chronic alcohol abuse in different stages of alcohol-induced liver disease. J. Hepatol. 2000, 32 (5): 742–7. PMID 10845660. doi:10.1016/S0168-8278(00)80242-1.
- ^ Ceccanti M, Attili A, Balducci G, Attilia F, Giacomelli S, Rotondo C, Sasso GF, Xirouchakis E, Attilia ML. Acute alcoholic hepatitis. J. Clin. Gastroenterol. 2006, 40 (9): 833–41. PMID 17016141. doi:10.1097/01.mcg.0000225570.04773.5d.
- ^ 35.0 35.1 35.2 Stephens DS, Greenwood B, Brandtzaeg P. Epidemic meningitis, meningococcaemia, and Neisseria meningitidis. Lancet. 2007, 369 (9580): 2196–210. PMID 17604802. doi:10.1016/S0140-6736(07)61016-2.
- ^ Merx, MW; Weber, C. Sepsis and the heart.. Circulation. 2007-08-14, 116 (7): 793–802. PMID 17698745. doi:10.1161/CIRCULATIONAHA.106.678359.
- ^ Kumar, A; Thota, V; Dee, L; Olson, J; Uretz, E; Parrillo, JE. Tumor necrosis factor alpha and interleukin 1beta are responsible for in vitro myocardial cell depression induced by human septic shock serum.. The Journal of experimental medicine. 1996-03-01, 183 (3): 949–58 [2019-11-08]. PMID 8642298. doi:10.1084/jem.183.3.949.
- ^ Brealey, D; Brand, M; Hargreaves, I; Heales, S; Land, J; Smolenski, R; Davies, NA; Cooper, CE; Singer, M. Association between mitochondrial dysfunction and severity and outcome of septic shock.. Lancet (London, England). 2002-07-20, 360 (9328): 219–23. PMID 12133657. doi:10.1016/S0140-6736(02)09459-X.
- ^ Chagnon, F; Metz, CN; Bucala, R; Lesur, O. Endotoxin-induced myocardial dysfunction: effects of macrophage migration inhibitory factor neutralization.. Circulation research. 2005-05-27, 96 (10): 1095–102. PMID 15879312. doi:10.1161/01.RES.0000168327.22888.4d.
- ^ Moreno-Navarrete JM, Ortega F, Serino M, Luche E, Waget A, Pardo G, Salvador J, Ricart W, Frühbeck G, Burcelin R, Fernández-Real JM. Circulating lipopolysaccharide-binding protein (LBP) as a marker of obesity-related insulin resistance. Int J Obes (Lond). 2012, 36 (11): 1442–9. PMID 22184060. doi:10.1038/ijo.2011.256.
- ^ Lepper PM, Schumann C, Triantafilou K, Rasche FM, Schuster T, Frank H, Schneider EM, Triantafilou M, von Eynatten M. Association of lipopolysaccharide-binding protein and coronary artery disease in men. J. Am. Coll. Cardiol. 2007, 50 (1): 25–31. PMID 17601541. doi:10.1016/j.jacc.2007.02.070.
- ^ Ruiz AG, Casafont F, Crespo J, Cayón A, Mayorga M, Estebanez A, Fernadez-Escalante JC, Pons-Romero F. Lipopolysaccharide-binding protein plasma levels and liver TNF-alpha gene expression in obese patients: evidence for the potential role of endotoxin in the pathogenesis of non-alcoholic steatohepatitis. Obes Surg. 2007, 17 (10): 1374–80. PMID 18000721. doi:10.1007/s11695-007-9243-7.
- ^ Cani PD, Amar J, Iglesias MA, Poggi M, Knauf C, Bastelica D, Neyrinck AM, Fava F, Tuohy KM, Chabo C, Waget A, Delmée E, Cousin B, Sulpice T, Chamontin B, Ferrières J, Tanti JF, Gibson GR, Casteilla L, Delzenne NM, Alessi MC, Burcelin R. Metabolic endotoxemia initiates obesity and insulin resistance. Diabetes. 2007, 56 (7): 1761–72. PMID 17456850. doi:10.2337/db06-1491.
- ^ Fei N, Zhao L. An opportunistic pathogen isolated from the gut of an obese human causes obesity in germfree mice. ISME J. December 2012, 7 (4): 880–4. PMC 3603399
 . PMID 23235292. doi:10.1038/ismej.2012.153.
. PMID 23235292. doi:10.1038/ismej.2012.153.
- ^ Wicks IP, Howell ML, Hancock T, Kohsaka H, Olee T, Carson DA. Bacterial lipopolysaccharide copurifies with plasmid DNA: implications for animal models and human gene therapy. Human Gene Therapy. March 1995, 6 (3): 317–323. PMID 7779915. doi:10.1089/hum.1995.6.3-317.
- ^ Watanabe J, Miyazaki Y, Zimmerman GA, Albertine KH, McIntyre TM. Endotoxin contamination of ovalbumin suppresses murine immunologic responses and development of airway hyper-reactivity. The Journal of Biological Chemistry. October 2003, 278 (43): 42361–42368. PMID 12909619. doi:10.1074/jbc.M307752200
 .
.
- ^ Komski L. The Detection of Endotoxins Via the LAL Test, the Chromogenic Method. Wako Chemicals USA, Inc. 16 December 2014 [14 March 2015]. (原始内容存档于29 March 2015).
