電池
此條目需要補充更多來源。 (2016年11月22日) |
| 電池 | |
|---|---|
 各種電池和電池組(從左上到右下):兩節AA電池,一節D電池,一塊手持(業餘無線電)電池,兩節9伏電池(PP3),兩節AAA電池,一節C電池,一塊攝像機電池,一塊無繩電話電池。 | |
| 類型 | 電源 |
| 工作原理 | 電化學反應, 電動勢 |
| 投產年 | 1800s |
| 電路符號 | |
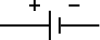 | |

電池(electric battery)全稱電池組,是由一個或多個帶外部連接的電化學電池(electrochemical cell)組成的電源裝置[1],用於為電氣設備供電;電池組若由多個電化學電池組成,它們之間可以並聯、串聯或串並聯方式連接。
狹義上,電池是將本身儲存的化學能轉換成電能的裝置;廣義上,電池是將「預先儲存」起來的能量轉化為可供外用電能的裝置[2]。因此,像太陽能電池,只有轉化而無儲存功能的裝置並不算是電池。其他名稱有電瓶、電芯,而中文「池」及「瓶」也有儲存作用之意。
英語單一個電池結構叫做「cell」(單電池),內部有多個 cells 並連或串連的結構叫做「battery」(電池組)。雖然在電池發展史上,「battery」一詞特指由多個「cells」組成的裝置;然而,英語本身的用法也起了演變,「battery」此術語的意涵已演化成涵蓋由單一「cell」構成的裝置[3]。
電池發展史
[編輯]電池的歷史可以追溯到兩千多年前的古伊拉克時代。是在首都巴格達發現的素燒陶壺(巴格達電池)它是一種使用銅和鐵的電池。考古者發現的物品被認為是至今發現的最早的電池證據。 而現代真正作為化學能的儲藏體,根據人們的需要可控制地放出電能的裝置在當時稱為Volta Pile(伏打電堆)。第一塊真正意義上的現代電池由意大利化學家亞歷山德羅·朱塞佩·安東尼奧·阿納斯塔西奧·伏打發明。
-
目前已知的全球第一個電池
-
車用鉛酸電池
-
穿戴式鋰電池
電池種類
[編輯]化學電池
[編輯]化學電池、電化電池、電化學電池或電化學池是指通過氧化還原反應,把正極、負極活性物質的化學能,轉化為電能的一類裝置。與普通氧化還原反應不同的是氧化和還原反應是分開進行的,氧化在負極,還原在正極,而電子得失是通過外部線路進行的,所以形成了電流。這是所有電池的本質特點。經過長期的研究、發展,化學電池迎來了品種繁多,應用廣泛的局面。大到一座建築方能容納得下的巨大裝置,小到以毫米計的類型。現代電子技術的發展,對化學電池提出了很高的要求。每一次化學電池技術的突破,都帶來了電子設備革命性的發展。世界上很多電化學科學家,把興趣集中在做為電動汽車動力的化學電池領域。

乾電池和液體電池
[編輯]乾電池和液體電池的區分僅限於早期電池發展的那段時期。最早的電池由裝滿電解液的玻璃容器和兩個電極組成。後來推出了以糊狀電解液為基礎的電池,也稱做乾電池。
現在仍然有「液體」電池。一般是體積非常龐大的品種。如那些做為不間斷電源的大型固定型鉛酸蓄電池或與太陽能電池配套使用的鉛酸蓄電池。對於移動設備,有些使用的是全密封,免維護的鉛酸蓄電池,這類電池已經成功使用了許多年,其中的電解液硫酸是由硅凝膠固定。
一次性電池和可充電電池
[編輯]- 一次性電池
一次性電池(Primary Battery)俗稱「用完即棄」電池及原電池,因為它們的電量耗盡後,無法再充電使用,只能丟棄。常見的一次性電池包括:
- 碳鋅電池—電壓約1.5V,電池容量較少,能輸出的電流也較少,不會如同鹼錳電池在長期存放後,漏出有害腐蝕液體,所以仍被使用於低用電量同時需長期使用的裝置,例如鐘、紅外線搖控等。
- 鹼錳電池—電壓約1.5V,電池容量及輸出的電流較鋅錳電池高,但不及鎳氫電池,長期存放後漏出有害腐蝕液體。
- 鋰電池—電壓約3V,電池容量及輸出的電流極高,可以存放十年仍有相當電力,但價錢較貴。
其他的一次性電池包括有鋅電池、鋅空電池、鋅汞電池、水銀電池、氫氧電池和鎂錳電池。
- 可充電電池
可充電電池又稱二次電池(Secondary Battery)或二級電池、蓄電池。可充電電池按製作材料和工藝上的不同,其優點是在充電後可多次循環使用,它們可全充放電兩百多次甚至達40000次,充電電池的輸出電流負荷力要比大部分一次性電池高。常見的類型有:
- 鉛酸電池—每個Cell的電壓約2V,容量低但可輸出較大的功率、電池,常使用於汽車中作啟動引擎用,或用於不斷電系統(UPS)、無線電機、通信機。
- 鎳鎘電池NiCd—電壓約1.2V,有較強烈的記憶效應,而且容量較低,含有毒物質,對環境有害,現已被淘汰。
- 鎳氫電池NiMH—電壓約1.2V,有極輕微的記憶效應,容量較鎳鎘電池及鹼性電池大,可充放電循環使用數百至二千幾次。舊鎳氫電池有較大的自放電,新的低自放電鎳氫電池自放電低至與鹼性電池相約,而且可在低溫下使用(-20℃),充電裝置、電壓與鎳鎘電池相同,已取代了鎳鎘電池,同時也可取代絕大部份鹼性電池的用途,也有用於混合動力車的。
- 鋰離子電池Li-ion—電壓約3.6V、3.7V,鋰離子電池具有重量輕(容量是同重量的鎳氫電池的1.5倍~2倍)、容量大、無記憶效應等優點,具有很低的自放電率,因而即使價格相對較高,仍然得到了普遍應用,包括許多電子產品,而且不含有毒物質,但這類用於消費性電子產品的Li-ion電池在存放一段時期後電量會永久減少。另也有用於純電動車及混合動力車的Li-ion電池,用於這用途的鋰離子電池容量相對略低,但有較大的輸出、充電電流,也有的有較長的壽命,但成本較高。
燃料電池
[編輯]
燃料電池是一種將燃料的化學能透過電化學反應直接轉化成電能的裝置,與一般電化電池不同的是反應物不儲存在電池內,只在反應時灌入電池。
燃料電池是利用氫氣在陽極進行氧化反應,將氫氣氧化成氫離子,而氧氣在陰極進行還原反應,與由陽極傳來的氫離子結合生成水。氧化還原反應過程中就可以產生電流。
燃料電池的技術包括了出現鹼性燃料電池(AFC)、磷酸燃料電池(PAFC)、質子交換膜燃料電池(PEMFC)、熔融碳酸鹽燃料電池(MCFC)、固態氧化物燃料電池(SOFC),以及直接甲醇燃料電池(DMFC)等,而其中,利用甲醇氧化反應作為正極反應的燃料電池技術,更是被業界所看好而積極發展。
水啟動電池
[編輯]水啟動電池本身不含電解質,出廠時還不會產生電力,須待加入水之後,才讓成份間的化學反應得以開始,並產生電力。
核電池
[編輯]
原子能電池(又稱核電池,氚電池或放射性同位素發電裝置)是指使用放射性同位素衰變時產生之能量來產生電力的裝置。這會使人誤解成核反應堆,但實際上這種電池不是利用鏈式反應來產生能量。核電池比起一般電池有很長的壽命且其輸出能量遠比一般化學電池為高,可惜其製作成本也相對很高,使這種電池多用於一些需長時間運作又難以更換電池的儀器之上。
核電池之技術早在1913年已經被亨利·莫塞萊所發明,使眾科學家都期望此技術能夠用於太空儀器上。但由於一直無法提高能源效率,這技術到近年納米技術研發出更有效之半導體後再被關注。此種電池現應用於衛星、宇航工具,也有於地面上使用。第一個離開太陽系的太空探測器航行者一號就是用這類電池作為能源,供應電力給探測器上的儀器。 核電池大致分成兩種類,分別是熱轉換型核電池(例如放射性同位素熱電機、斯特林放射性同位素高階熱電機)及非熱轉換型核電池。
電池容量
[編輯]電池容量是指電池所能儲存的電荷量,電池容量的符號為Q,單位為庫倫(C),但日常生活中多以安培小時(Ah)為單位,由於日常生活使用的電池也有容量相對較少,所以也有用毫安培小時(mAh)單位,也即千分之一安培小時,例如手機所使用的電池通常以後者為標記。
決定電池容量的因素有: 電池的種類(也即製造電池的物質):同一體積,不同種類的電池有不同的容量,例如鋰電池的容量較很多其他電池為高。 電池的體積:由於物質的化學能的能量密度是固定的,因此體積越大,總藏能量就越多,例如一枚AA電池的容量比AAA電池為大。 電池的溫度:一般情況下,溫度越低,電池的有效容量會減小,不同種類的電池減小的程度各有不同,所以在寒冷地區使用電池時需要特別留意。 放電速率:放電電流越大,同一電池的有效容量會越小,所以推高耗電的電器時電池的容量會減少,例如一枚能點亮2W燈泡一小時的電池,推動4W燈泡時就不能有半小時,必定比半小時短些,短多少就視乎電池種類、溫度…等因素而定。
所以同一枚電池在不同環境下會有不同容量,所以一般電池所標示的容量只可作參考,實際使用仍會因環境及其他工作條件而有所變化。而標示容量一般都以室溫情況下作準。
容量、放電電流與C值
[編輯]要計算一電池在某一放電流下能連續放電多久,方法是將容量除以電流:
當中,t(h)是放電時間(單位是小時)、Q(Ah)是電池容量(單位是安倍小時)、I(A)是電流(安培)。
而放電(或充電)電流也有用C值來表述,1個C的放電電流會剛好在一小時把電池完全放電,也就是1個C的電流是相對電池容量而定。例如一枚600mAh的電池,1個C的電流即是600mA,以這個電流放電會在一小時內用完電量。同樣地,對一枚2500mAh的電池,1C就是2500mA。又例如以0.5C對電池放電的話,不管電池容量多小,電池都會在2小時用完(1/0.5=2)。
用C作表述的特點在於在相同電池種類、操作環境下,不同容量的電池在同一C值放電率下,理論上都應該有相約放電時間。所以當要比較不同電池性能時,會選擇同一C值的放電或充電速率作比較。電池生產商在電池的規格上也多以C值表述放電電流及充電電流的速率。
電池型號
[編輯]
常見的電池型號或稱呼如下:[4]
| 美國型號 | 中國大陸型號 | 臺灣型號 | 香港稱呼 | 尺寸(高度×直徑)mm |
|---|---|---|---|---|
| D | 1號電池 | 1號電池 | 大電 | 59.0*32.3 |
| C | 2號電池 | 2號電池 | 中電 | 49.5*25.3 |
| AA | 5號電池 | 3號電池 | 細電 / 2A電 | 49.0*14.0 |
| AAA | 7號電池 | 4號電池 | 3A電 | 44.0*10.0 |
| AAAA | 9號電池 | 6號電池 | 4A電 | 41.5*8.1 |
| A | 4號電池 | 49.0*16.8 | ||
| SC | 3號電池 | 42.0*22.1 | ||
| N | 8號電池 | 5號電池 | 28.5*11.7 | |
| F | 89.0*32.3 |
壽命
[編輯]
電池壽命(及其同義詞電池壽命)對於可充電電池有兩個含義,但對於不可充電電池只有一個含義。對於可充電電池,它可以指設備在充滿電池電量時運行的時間長度,或是在電池單元失效前可以進行的充放電循環次數。對於不可充電電池,這兩種壽命是相等的,因為按定義電池只持續一個循環。(術語「保質期」用於描述電池在製造和使用之間保持性能的時間。)所有電池的可用容量在溫度降低時都會下降。與今天大多數電池不同,1812年發明的詹博尼電池堆在不經過翻新或充電的情況下提供了非常長的使用壽命,儘管它僅在納安(nanoamp)範圍內提供電流。自1840年以來,牛津電鈴在其原始電池對上幾乎持續不斷地鳴響,據信這些電池是詹博尼電池堆。
在室溫(20–30 °C)下存放時,一次性電池通常每年會失去其原始電荷的8–20%。[5] 這被稱為「自放電」速率,是由於即使沒有負載,電池單元內部仍然會發生非產生電流的「側」化學反應。低溫下存放的電池的側反應速率會降低,儘管有些電池可能會受到冷凍的損壞。舊的可充電電池自放電速度比一次性鹼性電池快得多,尤其是鎳基電池;一個剛剛充滿電的鎳鎘(NiCd)電池在前24小時內會失去10%的電荷,之後以約每月10%的速度放電。然而,較新的低自放電鎳金屬氫化物(NiMH)電池和現代鋰電池設計顯示出較低的自放電率(但仍然高於一次性電池)。
電池板上的活性物質在每次充放電循環中都會改變化學組成;由於體積的物理變化,活性物質可能會丟失,從而進一步限制電池的可充電次數。大多數鎳基電池在購買時都部分放電,必須在第一次使用之前充電。[6] 較新的NiMH電池在購買時就可以使用,並且一年內只有15%的放電率。[7]
每次充放電循環都會發生一些惡化。降解通常是因為電解質從電極遷移或活性物質從電極分離造成的。低容量的NiMH電池(1,700–2,000 mA·h)可以充電約1,000次,而高容量的NiMH電池(2,500 mA·h以上)大約可以持續500個循環。[8] NiCd電池在其內部電阻永久性地增加到超出可用值之前,往往被評為1,000次循環。快速充電會增加組件變化,縮短電池壽命。[8] 如果充電器不能檢測到電池何時充滿電,則過充的可能性很大,從而損壞電池。[9]
如果以特定的重複方式使用NiCd電池,可能會出現容量下降的情況,稱為「記憶效應」。[10] 這種效應可以通過簡單的做法避免。儘管化學性質相似,NiMH電池的記憶效應較少。[11]
汽車的鉛酸電池必須承受由振動、衝擊和溫度範圍引起的應力。由於這些應力以及它們的鉛板的硫酸鹽化,很少有汽車電池在正常使用六年後還能繼續使用。[12]汽車起動電池(SLI:起動,照明,點火)電池有許多薄板以最大限度地增加電流。一般來說,板越厚,壽命越長。它們通常只在充電前稍微放電。深循環鉛酸電池,如電動高爾夫球車中使用的電池,具有更厚的板以延長壽命。[13][14] 鉛酸電池的主要優點是成本低;其主要缺點是在給定容量和電壓下,尺寸和重量較大。鉛酸電池永遠不應放電至其容量的20%以下, 因為內部電阻會在充電時產生熱量和損壞。深循環鉛酸系統通常使用低電荷警告燈或低電荷斷電開關,以防止會縮短電池壽命的損壞類型。[15]
電池壽命可以通過將電池存放在低溫環境中來延長,例如冰箱或冰櫃,從而減緩側反應。這種存儲可以將鹼性電池的壽命延長約5%;可充電電池可以更長時間地保持其電荷,具體取決於類型。[16] 為了達到它們的最大電壓,電池必須恢復到室溫;在0°C下以250 mAh放電的鹼性電池的效率只有在20°C下的一半。[17] 鹼性電池製造商,如杜拉克,不建議將電池冷藏。
參見
[編輯]參考資料
[編輯]- ^ Crompton, T. R. Battery Reference Book third. Newnes. 2000-03-20: Glossary 3 [2016-03-18]. ISBN 978-0-08-049995-6. (原始內容存檔於2021-01-22).
- ^ Feedline:WHAT IS A BATTERY?。. (原始內容存檔於2013-04-06).
- ^ Pistoia, Gianfranco. Batteries for Portable Devices. Elsevier. 2005-01-25: 1 [2016-03-18]. ISBN 978-0-08-045556-3. (原始內容存檔於2021-01-22).
- ^ 电池型号规格. [2017-09-13]. (原始內容存檔於2021-07-28).
- ^ Self discharge of batteries. www.corrosion-doctors.org. [2007-09-09]. (原始內容存檔於2007-09-11).
- ^ Energizer Rechargeable Batteries & Battery Chargers. FAQs for Rechargeable Batteries from Energizer.com. web.archive.org. 2009-02-09 [2009-02-03]. 原始內容存檔於2009-02-09.
- ^ SANYO eneloop | Ready to use Rechargeable Battery - The only battery you will ever need. web.archive.org. 2010-02-02 [2010-02-03]. (原始內容存檔於2010-02-02).
- ^ 8.0 8.1 Rechargeable battery Tips - NIMH Technology Information. web.archive.org. 2007-08-08 [2007-08-012]. (原始內容存檔於2007-08-08).
- ^ Battery Myths vs Battery Facts. www.greenbatteries.com. [2007-08-10]. (原始內容存檔於2023-05-06).
- ^ Filip M. Gieszczykiewicz. Sci.Electronics FAQ: More Battery Info. www.repairfaq.org. [2018-08-08]. (原始內容存檔於2020-10-03).
- ^ RechargheableBatteryInfo.com. What does memory effect mean?. web.archive.org. 2007-07-15 [2007-07-15]. 原始內容存檔於2007-07-15.
- ^ Rich, Vincent (1994). The International Lead Trade. Cambridge: Woodhead. 129.
- ^ Deep Cycle Battery FAQ. web.archive.org. 2010-07-22 [2010-08-08]. (原始內容存檔於2010-07-22).
- ^ Dire, Daniel J. Tấm pin năng lượng mặt trời 1000w giá bao nhiêu. European Union. 2007-07-26 [2008-08-18]. (原始內容存檔於2023-08-07).
- ^ Deep Cycle Batteries: Renewable Energy - Energy Matters. web.archive.org. 2009-02-17 [2009-08-08]. 原始內容存檔於2009-02-17.
- ^ Does putting batteries in the freezer make them last longer?. web.archive.org. 2006-04-27 [2006-08-08]. 原始內容存檔於2006-04-27.
- ^ Alkaline Manganese Dioxide Handbook and Application Manual (PDF). 2008-08-25 [2023-08-08]. (原始內容存檔 (PDF)於2018-10-08).





