臨界點 (熱力學)

在熱力學中,臨界點是相圖中某平衡曲線的終點。其中一個例子就是液態-氣態的臨界點,是說明物質液態氣態共存條件的溫度-壓強曲線的終點,溫度較高時,氣態會變成超臨界流體,無法單靠加壓回到液態。臨界點有其溫度(臨界溫度Tc)和壓強(臨界壓強pc),在臨界溫度和壓強下,特定兩相之間的邊界消失。其他例子包括混合物中的液態–液態臨界溫度,以及在沒有外部磁場下,鐵磁性轉變成順磁性的轉換點(居里點)[2]。
液態-氣態的臨界點
[編輯]
為了簡單以及讓概念清楚,要討論通用定義的臨界點時需要先從一個特定的例開始,此處會用液態-氣態的臨界點,這是第一個發現的臨界點,也是最多人知道及研究的臨界點。
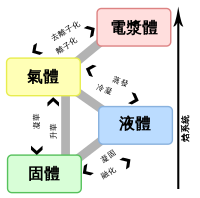
圖中說明純物質的壓強–溫度相圖,常見的三個相,固態、液態、氣態之間有相邊界線隔開,相邊界線也就是兩相可以共存的壓強–溫度條件。在三相點時,三相可以共存,而液態–氣態的相邊界線有一終點,終點即為臨界點,溫度為臨界溫度(Tc),而其壓強即為臨界壓強(pc)。
水的臨界點是溫度647.096 K(373.946 °C;705.103 °F)及壓強22.064百萬帕斯卡(3,200.1磅力每平方英寸;217.75標準大氣壓;220.64巴)[3]。
在臨界點附近時,液態和氣態性質都會大幅變化,且液態和氣態性質會越來越接近。以水為例,在一般條件下,水幾乎不可壓縮、熱膨脹系數小、是高相對電容率的良好介電質,是電解質的良好溶劑。但在臨界點附近, 上述性質都往反方向變化:水變成可壓縮、可熱膨脹、不適合作介電質,無法溶解電解質,也更容易和非極性氣體和有機分子混合[4]。
臨界點只會存在一相,汽化熱為零。在壓強體積圖的等溫度線(constant-temperature line)會出現拐點。表示在臨界點處[5][6][7]:

在臨界點以上的物質態是和液態和氣體相連的,可以在沒有相變的情形下進行轉換,此一物質態稱為超臨界流體。有一個教材書中常提到的知識,是指超過臨界點後就無法分辨是液態還是氣態,米高·費希爾和本傑明·維多姆已對此觀念提出挑戰[8],他們發現了分隔不同漸近統計學性質的p–T線(費希爾–維多姆線)。
歷史
[編輯]
臨界點的存在最早是由Charles Cagniard de la Tour在1822年發現的[9][10],由德米特里·門捷列夫在1860年命名[11][12]而托馬斯·安德魯斯在1869年也為其命名[13]。Cagniard發現31 °C的CO2可以在73 atm壓強下液化。但若溫度略高,就算壓強上昇到3000 atm,都無法液化。
理論
[編輯]不過范德華方程式是以平均場論為基礎,在臨界點附近不成立,而且所預測的冪定律是錯的。
為了分析臨界點附近的流體性質,定義了對比性質(簡化性質,reduced properties),是以臨界點性質為基礎所定義的[14]。
對應狀態原理指出有相同對比壓強和對比溫度的物質會有相同的體積。此關係對大多數物質大致成立,再在'pr很大時準確度會下降。
有些氣體有額外的修正系數,稱為Newton's correction,加在用上述方式計算的臨界溫度和臨界壓強上。其值是靠實驗推導,在不同的壓強範圍有不同的值[15]。
特定物質的臨界溫度以及臨界壓強
[編輯]| Substance[16][17] | 臨界溫度 | 臨界溫度(絕對壓強) |
|---|---|---|
| 氬 | −122.4 °C(150.8 K) | 48.1 atm(4,870 kPa) |
| 氨 (NH3)[18] | 132.4 °C(405.5 K) | 111.3 atm(11,280 kPa) |
| R-134a | 101.06 °C(374.21 K) | 40.06 atm(4,059 kPa) |
| R-410A | 72.8 °C(345.9 K) | 47.08 atm(4,770 kPa) |
| 溴 | 310.8 °C(584.0 K) | 102 atm(10,300 kPa) |
| 銫 | 1,664.85 °C(1,938.00 K) | 94 atm(9,500 kPa) |
| 氯 | 143.8 °C(416.9 K) | 76.0 atm(7,700 kPa) |
| 乙烷(C2H6) | 31.17 °C(304.32 K) | 48.077 atm(4,871.4 kPa) |
| 乙醇(C2H5OH) | 241 °C(514 K) | 62.18 atm(6,300 kPa) |
| 氟 | −128.85 °C(144.30 K) | 51.5 atm(5,220 kPa) |
| 氦 | −267.96 °C(5.19 K) | 2.24 atm(227 kPa) |
| 氫 | −239.95 °C(33.20 K) | 12.8 atm(1,300 kPa) |
| 氪 | −63.8 °C(209.3 K) | 54.3 atm(5,500 kPa) |
| 甲烷(CH4) | −82.3 °C(190.8 K) | 45.79 atm(4,640 kPa) |
| 氖 | −228.75 °C(44.40 K) | 27.2 atm(2,760 kPa) |
| 氮 | −146.9 °C(126.2 K) | 33.5 atm(3,390 kPa) |
| 氧 | −118.6 °C(154.6 K) | 49.8 atm(5,050 kPa) |
| 二氧化碳 | 31.04 °C(304.19 K) | 72.8 atm(7,380 kPa) |
| 一氧化二氮 | 36.4 °C(309.5 K) | 71.5 atm(7,240 kPa) |
| 硫酸 | 654 °C(927 K) | 45.4 atm(4,600 kPa) |
| 氙 | 16.6 °C(289.8 K) | 57.6 atm(5,840 kPa) |
| 鋰 | 2,950 °C(3,220 K) | 652 atm(66,100 kPa) |
| 汞 | 1,476.9 °C(1,750.1 K) | 1,720 atm(174,000 kPa) |
| 硫 | 1,040.85 °C(1,314.00 K) | 207 atm(21,000 kPa) |
| 鐵 | 8,227 °C(8,500 K) | |
| 金 | 6,977 °C(7,250 K) | 5,000 atm(510,000 kPa) |
| 鋁 | 7,577 °C(7,850 K) | |
| 水[3][19] | 373.946 °C(647.096 K) | 217.7 atm(22,060 kPa) |
混合物:液態–液態臨界溫度
[編輯]
溶液的液態–液態臨界溫度也稱為臨界互溶溫度,出現在相圖的二相區裏。液態–液態臨界溫度是指一些熱力學變數(例如溫度或是壓強)的無窮小變化會將混合物變成兩種分離的液體,如右邊聚合物-溶劑的相圖所示。有兩個臨界溫度,其中的最高臨界互溶溫度(UCST)是冷卻會導致相分離的最高溫度點,而最低臨界互溶溫度是加熱會導致相分離的最低溫度點。
數學定義
[編輯]以理論的角度來看,液態–液態臨界溫度是spinodal曲線在溫度–濃度的極值,因此兩相系統的液態–液態臨界溫度需滿足兩者條件:spinodal曲線條件(吉布斯能相對濃度的二階導數為零),以及極值條件(吉布斯能相對濃度的三階導數為零,或是spinodal溫度相對濃度的導數為零)。
參見
[編輯]
|
|
參考資料
[編輯]- ^ Horstmann, Sven. Theoretische und experimentelle Untersuchungen zum Hochdruckphasengleichgewichtsverhalten fluider Stoffgemische für die Erweiterung der PSRK-Gruppenbeitragszustandsgleichung [Theoretical and experimental investigations of the high-pressure phase equilibrium behavior of fluid mixtures for the expansion of the PSRK group contribution equation of state] (學位論文). Oldenburg, Germany: Carl-von-Ossietzky Universität Oldenburg. 2000. ISBN 3-8265-7829-5. OCLC 76176158 (德語).
- ^ Stanley, H. Eugene. Introduction to phase transitions and critical phenomena. New York: Oxford University Press. 1987. ISBN 0-19-505316-8. OCLC 15696711.
- ^ 3.0 3.1 Wagner, W.; Pruß, A. The IAPWS Formulation 1995 for the Thermodynamic Properties of Ordinary Water Substance for General and Scientific Use. Journal of Physical and Chemical Reference Data. June 2002, 31 (2): 398. doi:10.1063/1.1461829.
- ^ Anisimov, Sengers, Levelt Sengers (2004): Near-critical behavior of aqueous systems. Chapter 2 in Aqueous System at Elevated Temperatures and Pressures Palmer et al., eds. Elsevier.
- ^ 5.0 5.1 P. Atkins and J. de Paula, Physical Chemistry, 8th ed. (W. H. Freeman 2006), p. 21.
- ^ K. J. Laidler and J. H. Meiser, Physical Chemistry (Benjamin/Cummings 1982), p. 27.
- ^ P. A. Rock, Chemical Thermodynamics (MacMillan 1969), p. 123.
- ^ Fisher, Michael E.; Widom, B. Decay of Correlations in Linear Systems. Journal of Chemical Physics. 1969, 50 (9): 3756 [9 January 2023]. Bibcode:1969JChPh..50.3756F. doi:10.1063/1.1671624.
- ^ Charles Cagniard de la Tour. Exposé de quelques résultats obtenu par l'action combinée de la chaleur et de la compression sur certains liquides, tels que l'eau, l'alcool, l'éther sulfurique et l'essence de pétrole rectifiée [Presentation of some results obtained by the combined action of heat and compression on certain liquids, such as water, alcohol, sulfuric ether (i.e., diethyl ether), and distilled petroleum spirit]. Annales de Chimie et de Physique. 1822, 21: 127–132 (法語).
- ^ Berche, B., Henkel, M., Kenna, R (2009) Critical phenomena: 150 years since Cagniard de la Tour. Journal of Physical Studies 13 (3), pp. 3001-1–3001-4.
- ^ 門捷列夫將其稱為「沸騰的絕對溫度」(абсолютная температура кипения; absolute Siedetemperatur).
- Менделеев, Д. О расширении жидкостей от нагревания выше температуры кипения [On the expansion of liquids from heating above the temperature of boiling]. Горный Журнал [Mining Journal]. 1861, 4: 141–152 (俄語).,「沸騰的絕對溫度」定義在151頁。 Wikimedia可以看到內容
- 德文翻譯:Mendelejeff, D. Ueber die Ausdehnung der Flüssigkeiten beim Erwärmen über ihren Siedepunkt [On the expansion of fluids during heating above their boiling point]. Annalen der Chemie und Pharmacie. 1861, 119: 1–11. doi:10.1002/jlac.18611190102 (德語). The "absolute temperature of boiling" is defined on p. 11: "Als absolute Siedetemperatur müssen wir den Punkt betrachten, bei welchem 1) die Cohäsion der Flüssigkeit = 0° ist und a2 = 0, bei welcher 2) die latente Verdamfungswärme auch = 0 ist und bei welcher sich 3) die Flüssigkeit in Dampf verwandelt, unabhängig von Druck und Volum." (As the "absolute temperature of boiling" we must regard the point at which (1) the cohesion of the liquid equals 0° and a2 = 0 [where a2 is the coefficient of capillarity, p. 6], at which (2) the latent heat of vaporization also equals zero, and at which (3) the liquid is transformed into vapor, independently of the pressure and the volume.)
- 門捷列夫在1870年認為他對臨界點的定義要早於Thomas AndrewsMendelejeff, D. Bemerkungen zu den Untersuchungen von Andrews über die Compressibilität der Kohlensäure [Comments on Andrews' investigations into the compressibility of carbon dioxide]. Annalen der Physik. 2nd series. 1870, 141 (12): 618–626. Bibcode:1870AnP...217..618M. doi:10.1002/andp.18702171218 (德語).
- ^ Landau, Lifshitz, Theoretical Physics, Vol. V: Statistical Physics, Ch. 83 [German edition 1984].
- ^ Andrews, Thomas. The Bakerian lecture: On the continuity of the gaseous and liquid states of matter (PDF). Philosophical Transactions of the Royal Society (London). 1869, 159: 575–590. S2CID 96898875. doi:10.1098/rstl.1869.0021. The term "critical point" appears on page 588.
- ^ Cengel, Yunus A.; Boles, Michael A. Thermodynamics: an engineering approach. Boston: McGraw-Hill. 2002: 91–93. ISBN 978-0-07-121688-3.
- ^ Maslan, Frank D.; Littman, Theodore M. Compressibility Chart for Hydrogen and Inert Gases. Ind. Eng. Chem. 1953, 45 (7): 1566–1568. doi:10.1021/ie50523a054.
- ^ Emsley, John. The Elements Second. Oxford University Press. 1991. ISBN 978-0-19-855818-7.
- ^ Cengel, Yunus A.; Boles, Michael A. Thermodynamics: An Engineering Approach
 Fourth. McGraw-Hill. 2002: 824. ISBN 978-0-07-238332-4.
Fourth. McGraw-Hill. 2002: 824. ISBN 978-0-07-238332-4.
- ^ Ammonia – NH3 – Thermodynamic Properties. www.engineeringtoolbox.com. [2017-04-07].
- ^ Critical Temperature and Pressure. Purdue University. [2006-12-19].