用户:Blaster~zhwiki/translating:Bromine
| |||||||||||||||||||
| 总体特性 | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
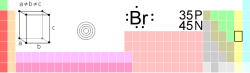
| 名称, 符号, 序号 | 溴、Br、35 | ||||||||||||||||||
| 系列 | 卤素 | ||||||||||||||||||
| 族, 周期, 元素分区 | 17族(VIIA), 4, p | ||||||||||||||||||
| 密度、硬度 | 3119 kg/m3(300K)、NA | ||||||||||||||||||
| 颜色和外表 | 气体/液体:棕红色 固体:带金属光泽 
| ||||||||||||||||||
| 地壳含量 | 6×10-4% | ||||||||||||||||||
| 原子属性 | |||||||||||||||||||
| 原子量 | 79.904 原子量单位 | ||||||||||||||||||
| 原子半径(计算值) | 115(94)pm | ||||||||||||||||||
| 共价半径 | 114 pm | ||||||||||||||||||
| 范德华半径 | 185 pm | ||||||||||||||||||
| 价电子排布 | [氩]3d104s24p5 | ||||||||||||||||||
| 电子在每能级的排布 | 2,8,18,7 | ||||||||||||||||||
| 氧化价(氧化物) | ±1,3,5,7(强酸性) | ||||||||||||||||||
| 晶体结构 | 正菱形 | ||||||||||||||||||
| 物理属性 | |||||||||||||||||||
| 物质状态 | 液态 | ||||||||||||||||||
| 熔点 | 265.8 K(-7.2 °C) | ||||||||||||||||||
| 沸点 | 332 K(59 °C) | ||||||||||||||||||
| 摩尔体积 | 19.78×10-6m3/mol | ||||||||||||||||||
| 汽化热 | 15.438 kJ/mol | ||||||||||||||||||
| 熔化热 | 5.286 kJ/mol | ||||||||||||||||||
| 蒸气压 | 5800 帕(280.1K) | ||||||||||||||||||
| 声速 | 206 m/s(293.15K) | ||||||||||||||||||
| 其他性质 | |||||||||||||||||||
| 电负性 | 2.96 (鲍林标度) | ||||||||||||||||||
| 比热 | 480 J/(kg·K) | ||||||||||||||||||
| 电导率 | 无数据 | ||||||||||||||||||
| 热导率 | 0.122 W/(m·K) | ||||||||||||||||||
| 第一电离能 | 1139.9 kJ/mol | ||||||||||||||||||
| 第二电离能 | 2103 kJ/mol | ||||||||||||||||||
| 第三电离能 | 3470 kJ/mol | ||||||||||||||||||
| 第四电离能 | 4560 kJ/mol | ||||||||||||||||||
| 第五电离能 | 5760 kJ/mol | ||||||||||||||||||
| 第六电离能 | 8550 kJ/mol | ||||||||||||||||||
| 第七电离能 | 9940 kJ/mol | ||||||||||||||||||
| 第八电离能 | 18600 kJ/mol | ||||||||||||||||||
| 最稳定的同位素 | |||||||||||||||||||
| |||||||||||||||||||
| 在没有特别注明的情况下使用的是 国际标准基准单位单位和标准气温和气压 | |||||||||||||||||||
溴 (希腊语:brómos,意义:"stench(公山羊的)") [1]),是一个化学元素,元素符号 Br ,原子序 35,是一个卤素原子。溴分子在标准温度和压力下是有挥发性的红棕色液体,活性介于氯与碘之间。 溴蒸气是有腐蚀性和有毒的。在2007年,约有556,000公吨的溴被制造。 [2] 溴的主要用途有阻燃剂和精细的化学品。
历史
[编辑]溴分别被两个科学家安东尼‧巴拉尔[3] 和Carl Löwig[4] 在1825年与1826年所发现。[5]
1826年,巴拉尔在蒙彼利埃的盐沼中的海苔的灰烬中发现溴盐,那些海苔是用来制备碘的,但其中也含有溴。巴拉尔从有着饱和氯的海苔灰溶液中分离出溴。 产物的性质被发现在氯与碘的中间,因此他试着证明该化合物是 一氯化碘 (ICl),但在失败后他确信他发现了一个新元素,并把他称之为muride,源自拉丁文字muria,意思是卤水。[3]
Carl Jacob Löwig在1825年从巴特克罗伊茨纳赫村里的水泉中分离出了溴。Löwig用了一个有饱和氯的矿物盐溶液,并用[[二乙醚]提取出了溴]。在醚蒸发后,留下了一些棕色的液体。他用此液体作为他工作的样本申请了一个在Leopold Gmelin的实验室的职位。由于发现的公开被延迟了,所以巴拉尔率先发表了他的结果。[4]
在法国科学家Louis Nicolas Vauquelin和Louis Jacques Thénard与约瑟夫·路易·盖-吕萨克证实了年轻药剂师巴拉尔的实验之后,结论出现在法国科学院的一场演讲上,并被发表在Annales de Chimie et Physique上。[6] 在他的发表上,巴拉尔说他基于M. Anglada.的建议把名子从muride改成了brôme。其他的说法则认为法国的化学与物理学家约瑟夫·路易·盖-吕萨克基于它蒸气的独特气味建议了这个名称。[7]溴直到1860年才被大量的制造。
在少数的药学应用之外,溴的第一个商业应用是用于银版摄影法。在1840年,发现到用溴制造银版摄影法用的光敏的卤化银在许多地方胜过之前所使用的碘蒸气。[8]
溴化钾与溴化钠再19世纪末期到二十世纪初期被用作抗癫痫药与镇静剂,直到他们渐渐的被2,2,2-三氯-1,1-乙二醇与巴必妥酸盐所取代。[9]
特征
[编辑]溴是唯一在室温下是液态的非金属元素,并且是周期表上在室温或接近室温下为液体的六个元素之一。溴的熔点是-7.2°C,而沸点是 58.8°C。元素单质的形式是双原子分子:Br2。它是黏稠,可流动的,红棕色的液体,并在标准温度和压力下容易挥发,形成红色的蒸气(颜色近似于二氧化氮)并且有一股与氯气相似的恶臭。溴是一种卤素,它的活性小于氯氮大于碘。溴微溶于水,但对二硫化碳,有机醇类(像甲醇)与有机酸的溶解度佳。它很容易与其他原子键结并有强烈的漂白作用。溴像氯一样,也有用在游泳池的维护。
一些特定的溴化合物被认为是有可能破坏臭氧层的或是具有生物累积性的。所以许多工业用的溴化合物不再被生产,被限制,或逐渐的淘汰。蒙特利尔公约提到了一些有机溴化物是需要被逐渐淘汰的的。
溴是一种强氧化剂。它会和金属和大部分有机化合物产生激烈的反应,若有水参与则反应更加剧烈,溴和金属反应会产生金属溴盐及次溴酸盐(有水参与时),和有机化合物则可能产生磷光或萤光化合物
同位素
[编辑]溴有两个稳定的同位素: 79Br (50.69 %) and 81Br (49.31%).其他至少有 23放射性同位素是已被发现可以存在的。[10]不少的溴同位素是核分裂的产物。有几种来自于核分裂产物的大原子量的溴同位素会产生延迟性的中子衰变。所有的放射性溴同位素的半衰期相对来讲是比较短的,半衰期最长的是一个中子数不足的同位素,77Br:2.376天。半衰期最长的丰中子同位素是82Br:1.47天。一些溴的同位素有亚稳定的同质异能素。稳定的 79Br有一个具放射性的同质异能素,半衰期4.86秒,它最终衰变成稳定的基态。[11]
自然存在形式及制备
[编辑]- 亦可参见卤化物矿物。
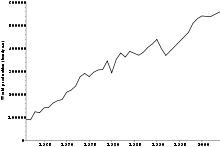
溴的双原子分子Br2不会自然存在,溴主要是以溴盐的形式散布在地壳中。由过滤法,溴盐在海水里的含量约65 ppm,[12]但它在海里的浓度比氯小。溴可以在溴含量丰富的卤井与死海(接近50000ppm)中商业开采。[13][14]

一年(2007)有接近556,000公吨(价值约25亿美金)的溴被制造,其中最主要的生产国是美国,以色列与中国。[15][16][17]溴的生产量自1960年代以来已经成长了六倍,美国溴含量最多的地方在 哥伦比亚县与犹尼昂县。[18]中国的溴来源位于山东省,而以色列的溴则源于死海的水。使用氯气来处理富含溴的卤水,在过程中,溴离子被氯气所氧化而形成溴分子。
- 2 Br− + Cl2 → 2 Cl− + Br2
由于溴的商业运用以及很长的保存时间,人们不会刻意的去制备它。但小量的溴可以经由固态溴化钠与浓硫酸 Small (H2SO4)。反应的第一步是制造气态的溴化氢(HBr),但于此反应条件下,部分的溴化氢会被进一步硫酸氧化形成溴分子(Br2)与二氧化硫(SO2)。
- NaBr (s) + H2SO4 (aq) → HBr (aq) + NaHSO4 (aq)
- 2 HBr (aq) + H2SO4 (aq) → Br2 (g) + SO2 (g) + 2 H2O (l)
使用相似的化合物,如使用稀盐酸与次氯酸钠也是可以的。最重要的是,该酸的阴离子(以上述的例子,硫酸根与氯离子)的电负度比溴还大,使取代反应能够发生。
化合物
[编辑]有机化学
[编辑]
有机化合物要被溴化有加成反应与取代反应两种途径。溴对烯的双键进行电加成,中途产生一个环状含溴的中间产物。在像二硫化碳之类的无水溶剂里,反应将产生二溴的产物。举例来说,它跟乙烯反应将会产生1,2-二溴乙烷,溴也可以对苯酚与苯胺进行加成反应。当用来反应的是溴水时,除了本来会出现的二溴化物外,有少部分的烯会被反应成[[卤代醇]。由于溴的反应是非常的可靠的,所以溴水被拿来做检测烯类、苯酚与苯胺的检测试剂。就像其他的卤素一样,溴也可以进行自由基反应,举例来说,烃类在光照下可被溴溴化。
溴,在有催化量的的磷的情况下,可以轻易的以溴化羧酸中的α-氢。这个方法被称做赫尔-乌尔哈-泽林斯基反应,是商业制溴乙酸法的基础。人们通常使用N-溴代琥珀酰亚胺来代替元素态的溴,因为它比较好处理,而且反应也比较温和且更具选择性。有机溴化物相对于活性较弱的有机氯化物与较贵的有机碘化物而言,是比较好的选择。因此,格氏试剂与有机锂化物通常使用相对应的有机溴化物来制造。
无机反应
[编辑]| 溴的氧化态 | |
|---|---|
| -1 | HBr |
| +1 | BrCl |
| +3 | BrF 3 |
| +5 | BrF 5 |
| +5 | BrO 3− |
| +7 | BrO 4− |
溴是一种氧化剂,它会把碘离子氧化成碘,同时自身还原成溴离子。
- Br2 + 2 I− → 2 Br− + I2
溴也会把金属与类金属氧化成相对应的溴化物,通常无水的溴与含水的溴比起来活性较低,但无水的溴会与铝、钛、汞、碱土金属与碱金属剧烈的反应。
如果溴是溶解在含水的氢氧化物中的话,溴离子(Br−)将会与次溴酸根(OBr−)一起产生,产生的次溴酸根是溴化物具有漂白能力的原因。在一些化合物中,次溴酸根的自身氧化还原是定量的,其产生的溴酸根是与氯酸根相当相似的强氧化剂。
- 3 OBr− → BrO3− + 2 Br−
过溴酸根无法使用制造过氯酸根的方法-电解来制造,其制造方法是将溴酸根与氟进行反应。
- O3Br− + H2O + F2 → BrO4− + 2 HF
用途
[编辑]许多种的有机溴化物在工业上有其应用,其中一部分是由溴制备而来,另一部分则是由溴化氢制备而来。而溴化氢则是以在溴中燃烧氢来取得。 [2]
加成反应[19]是制备1,2-二溴乙烷的过程,而1,2-二溴乙烷是有机溴化物中被制造的量最多的。
- C2H4 + Br2 → CH2BrCH2Br
阻燃物
[编辑]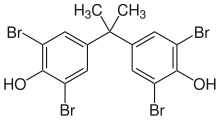
[含溴阻燃剂]]的重要性与日俱增,当燃烧发生时,阻燃剂会生成氢溴酸,它会干扰在火焰当中所进行的氧化连锁反应。高活性的氢、氧与氢氧根自由基会与溴化氢反应成活性没那么强的溴自由基。 [20][21] 含溴的化合物可以借由在聚合过程中加入一些被溴化的单体或在聚合后加入含溴化合物的方法加入聚合物中。添加四溴双酚A可以制造聚酯与环氧树脂,用于印刷电路板(PCB)的环氧树脂通常都是由阻燃剂制成的,并且在产品缩写中以FR来表示。(如FR-4与FR-2) 溴乙烯可以用来制造聚乙烯、聚氯乙烯与聚丙烯。十溴二苯醚可以添加在已完成的聚合物中。[22]
汽油添加剂
[编辑]1,2-二溴乙烷是添加在含铅汽油中的一种汽油添加剂,它借由产生挥发性的溴化铅来移除引擎中的铅,此类用法在美国占了1966年全部溴用量的77%,但这种用途在1970年代因为会污染环境而被禁止了。[23]此化合物也曾被当作杀虫用的熏剂,但此种应用也一样的被禁止了。 [17]
杀虫剂
[编辑]
溴甲烷曾被广泛的用做烟薰土地用的农药,蒙特利尔公约决定到2005年逐渐淘汰这种会破坏臭氧层的化合物。在1991年,估计有35,000公吨的此化合物被用来对付线虫动物、真菌、杂草还有一些土壤的问题。[24][25]
其他用途
[编辑]
- 钙、钠与锌的溴化物在溴的市场中占有一席之地,这些盐类在水里产生稠密的化合物,可以用来做钻井液,有时也被称做clear brine fluids。[26][17]
- 溴也可以用来生产含溴植物油,含溴植物油在许多橘子口味的软性饮料中当作乳剂。在此化合物于1940年代被发现后,它被广泛地使用,直到在1970年代中期,英国与美国限制了它的使用并且研发出了替代用的乳剂。[27]但在1997年美国的软性饮料仍然可以含有含溴植物油。[28]

- 某些染料、农业化学药品与药品是有机溴化合物。1-溴-3-氯丙烷、1-溴乙基苯与1-溴化烷是利用烯类与溴化氢的反马氏规则加成来制备的。溴化乙锭(EtBr)在凝胶电泳中当作DNA的染色剂。
- 高折射率的化合物。
- 水净化与消毒用化合物。[17]
- 溴化钾被一些摄影业者使用来防止雾(不希望出现的银的还原)的生成。
- 溴蒸气被用于敏化银版摄影法用的银版的第二步,该版之后会经过汞蒸气的处理。溴的脚色是加强刚被碘化的银版的光敏。
生物上的应用
[编辑]
溴在人体中还未找到已知的功能,但有机溴化合物的确自然存在。海中的有机物是有机溴化合物的主要来源,在1999年有超过1600种化合物被发现。其中最常见的是溴甲烷,海藻估计制造了56,000公吨的此化合物,[29]夏威夷的芦笋藻所制成的香精油中就含有80%的溴甲烷。[30]一个有名且已被人类长时间使用的有机溴化合物是泰尔紫,[31][29]这种含溴的紫色是被一种体型中等的掠食性海蜗牛,腹足纲的紫螺蜗牛,这种天然的有机溴化合物直到1909年才被Paul Friedländer所发现。[32]大部分自然界中的有机溴化合物是由溴化过氧化酶所产生的。[33]
安全
[编辑]元素状态的溴是有毒且有刺激性的。因为溴是一种氧化剂,它不能与大部分的有机或无机化合物稳定的共存,所以输送溴时需要谨慎,通常是使用内衬著铅的钢制桶子,并以监固的金属架支撑。
当某些特定的含溴离子化合物在酸性环境下与过锰酸钾(KMnO4)混合时,会产生淡棕色的溴雾,它闻起来像是漂白水,并且对黏膜有很强的刺激性。一旦有人暴露于其中,他应该立即移动至有新鲜空气的地方,如果出现了症状,那么他将会需要药物治疗
参考
[编辑]- ^ Gemoll W, Vretska K: Griechisch-Deutsches Schul- und Handwörterbuch ("Greek-German dictionary"), 9th ed., published by öbvhpt, ISBN 3-209-00108-1
- ^ 2.0 2.1 Jack F. Mills "Bromine" in Ullmann's Encyclopedia of Chemical Technology Wiley-VCH Verlag; Weinheim, 2002. DOI: 10.1002/14356007.a04_391
- ^ 3.0 3.1 Balard, Antoine. Memoire of a peculire Substance contained in Sea Water. Annals of Philosophy. 1826: 387– and 411–.
- ^ 4.0 4.1 Landolt, Hans Heinrich. Nekrolog: Carl Löwig. Berichte der deutschen chemischen Gesellschaft. 1890, 23 (3): 905–909. doi:10.1002/cber.18900230395.
- ^ Weeks, Mary Elvira. The discovery of the elements: XVII. The halogen family.. Journal of Chemical Education. 1932, 9: 1915.
- ^ Balard, A.J. Annales de Chimie et Physique. 32: 337–382. 1826. 缺少或
|title=为空 (帮助) - ^ Wisniak, Jaime. Antoine-Jerôme Balard. The discoverer of bromine (PDF). Revista CENIC Ciencias Químicas. 2004, 35 (1).
- ^ Barger, M. Susan; White, William Blaine. Technological Practice of Daguerreotypy. The Daguerreotype: Nineteenth-century Technology and Modern Science. JHU Press. 2000: 31–35. ISBN 9780801864582.
- ^ Shorter, Edward. A History of Psychiatry: From the Era of the Asylum to the Age of Prozac. John Wiley and Sons: 200–202. 1997. ISBN 9780471245315.
- ^ GE Nuclear Energy. Chart of the Nuclides, 14th Edition. 1989.
- ^ Audi, Georges. The NUBASE Evaluation of Nuclear and Decay Properties. Nuclear Physics A (Atomic Mass Data Center). 2003, 729: 3–128. doi:10.1016/j.nuclphysa.2003.11.001.
- ^
Tallmadge, John A.; Butt, John B.; Solomon Herman J. Minerals From Sea Salt. Ind. Eng. Chem.: 44–65. doi:10.1021/ie50655a008. 已忽略未知参数
|yaer=(帮助); - ^ Oumeish, Oumeish Youssef. Climatotherapy at the Dead Sea in Jordan. Clinics in Dermatology. 1996, 14 (6): 659–664. doi:10.1016/S0738-081X(96)00101-0.
- ^ Al-Weshah, Radwan A. The water balance of the Dead Sea: an integrated approach. Hydrological Processes. 2008, 14 (1): 145–154.
- ^ Emsley, John. Bromine. Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, England, UK: Oxford University Press. 2001: 69–73. ISBN 0198503407.
- ^ Lyday, Phyllis A. Comodity Report 2007: Bromine (PDF). United States Geological Survey. [2008-09-03].
- ^ 17.0 17.1 17.2 17.3 Lyday, Phyllis A. Mineral Yearbook 2007: Bromine (PDF). United States Geological Survey. [2008-09-03].
- ^ Bromine:An Important Arkansas Industry, Butler Center for Arkansas Studies
- ^ N. A. Khan, F. E. Deatherage, and J. B. Brown (1963). "Stearolic Acid". Org. Synth.; Coll. Vol. 4: 851.
- ^ Green, Joseph. Mechanisms for Flame Retardancy and Smoke suppression -A Review. Journal of Fire Sciences. 1996, 14 (6): 426–442. doi:10.1177/073490419601400602.
- ^ Kaspersma, Jelle; Doumena, Cindy; Munrob Sheilaand; Prinsa, Anne-Marie. Fire retardant mechanism of aliphatic bromine compounds in polystyrene and polypropylene. Polymer Degradation and Stability. 2002, 77 (2): 325–331. doi:10.1016/S0141-3910(02)00067-8.
- ^ Weil, Edward D.; Levchik, Sergei. A Review of Current Flame Retardant Systems for Epoxy Resins. Journal of Fire Sciences. 2004, 22 (1): 25–40. doi:10.1177/0734904104038107.
- ^ Alaeea, Mehran; Ariasb, Pedro; Sjödinc, Andreas; Bergman, Åke. An overview of commercially used brominated flame retardants, their applications, their use patterns in different countries/regions and possible modes of release. Environment International. 2003, 29 (6): 683–689. doi:10.1016/S0160-4120(03)00121-1.
- ^ Messenger, Belinda; Braun, Adolf. Alternatives to Methyl Bromide for the Control of Soil-Borne Diseases and Pests in California (PDF). Pest Management Analysis and Planning Program. 2000 [2008-11-17].
- ^ Decanio, Stephen J.; Norman, Catherine S. Economics of the "Critical Use" of Methyl bromide under the Montreal Protocol. Contemporary Economic Policy. 2008, 23 (3): 376–393. doi:10.1093/cep/byi028.
- ^ Darley, H. C. H.; Gray, George Robert. Composition and Properties of Drilling and Completion Fluids. Gulf Professional Publishing. : 61–62. ISBN 9780872011472. 已忽略未知参数
|yera=(帮助) - ^ Kaufman, Vered R.; Garti, Nissim. Effect of cloudy agents on the stability and opacity of cloudy emulsions for soft drinks. International Journal of Food Science & Technology. 1984, 19 (2): 255–261. doi:10.1111/j.1365-2621.1984.tb00348.x.
- ^ Horowitz, B. Zane. Bromism from Excessive Cola Consumption',Clinical Toxicology 35 (3): 315–320. 1997. doi:10.3109/15563659709001219.
- ^ 29.0 29.1 Gordon W. Gribble. The diversity of naturally occurring organobromine compounds. Chemical Society Reviews. 1999, 28 (5): 335. doi:10.1039/a900201d.
- ^ Volatile halogen compounds in the alga Asparagopsis taxiformis (Rhodophyta). Journal of Agricultural snd Food Chemistry. 1976, 24 (4): 856–861. doi:10.1021/jf60206a040. Authors list列表中的
|first1=缺少|last1=(帮助); 使用|coauthors=需要含有|author=(帮助) - ^ Gordon W. Gribble. Naturally Occurring Organohalogen Compounds. Acc. Chem. Res. 1998, 31 (3): 141–152. doi:10.1021/ar9701777.
- ^ Friedländer, P. Über den Farbstoff des antiken Purpurs aus murex brandaris. Berichte der deutschen chemischen Gesellschaft: 765–770. 已忽略未知参数
|yaer=(帮助) - ^ Butler, Alison; Carter-Franklin, Jayme N. The role of vanadium bromoperoxidase in the biosynthesis of halogenated marine natural products. Natural Product Reports. 2004, 21: 180–188. doi:10.1039/b302337k.
外部链接
[编辑]- Los Alamos National Laboratory – Bromine
- WebElements.com – Bromine
- Theodoregray.com – Bromine
- USGS Minerals Information: Bromine
- Bromine Science and Environmental Forum (BSEF)
- Thermal Conductivity of BROMINE
- Viscosity of BROMINE
- 元素溴在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 溴(英文)
- 元素溴在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素溴在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 溴(英文)
| |||||||||||||||||