一氧化二硫
外觀
| 一氧化二硫 | |
|---|---|
| |
| |
| 識別 | |
| CAS號 | 20901-21-7([1]) |
| PubChem | 140772 |
| ChemSpider | 124163 |
| SMILES |
|
| InChI |
|
| InChIKey | TXKMVPPZCYKFAC-UHFFFAOYSA-N |
| 性質 | |
| 化學式 | S2O |
| 莫耳質量 | 80.1294 g/mol[1] g·mol⁻¹ |
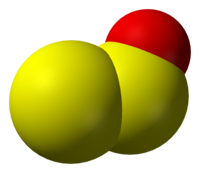
| 外觀 | 無色氣體或暗紅色固體[2] |
| 結構 | |
| 配位幾何 | 角形 |
| 危險性 | |
| 主要危害 | 有毒 |
| 相關物質 | |
| 相關化學品 | 三硫 一氧化硫, 臭氧, 二氧化硫 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
一氧化二硫是具有化學式S2O的無機化合物。它是低氧化硫之一。它是一種無色氣體,會冷凝形成淺色固體,在室溫下不穩定。 [3]
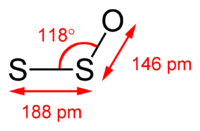
它是一個角形的分子,具有一個S-S-O角為117.88°,S-S的鍵長度為188.4pm,S-O的鍵長則為146.5pm。[4]
製備
[編輯]- 3 S8 + 12 CuO → 12 CuS + 4 S2O + 4 SO2
- SOCl2 + Ag2S → 2 AgCl + S2O
- 3 SO → SO2 + S2O
參見
[編輯]參考資料
[編輯]- ^ 1.0 1.1 1.2 Disulfur monoxide. NIST. 2008 [2020-02-08]. (原始內容存檔於2021-06-18).
- ^ B Hapke and F Graham. Spectral properties of condensed phases of disulfur monoxide, polysulfur oxide, and irradiated sulfur. Icarus. May 1989, 79 (1): 47. Bibcode:1989Icar...79...47H. doi:10.1016/0019-1035(89)90107-3.
- ^ R. Steudel: Sulfur-Rich Oxides SnO and SnO2" in Elemental Sulfur und Sulfur-Rich Compounds II, Steudel, R., 2003, Springer, Berlin-Heidelberg. ISBN 9783540449515
- ^ Meschi, D. J.; Myers, R. J. The microwave spectrum, structure, and dipole moment of disulfur monoxide. Journal of Molecular Spectroscopy. 1959, 3 (1–6): 405–416. Bibcode:1959JMoSp...3..405M. doi:10.1016/0022-2852(59)90036-0.
- ^ 5.0 5.1 Ralf Steudel, [《一氧化二硫》在Google Books的內容。 Elemental Sulfur and Sulfur-Rich Compounds II], Springer. 2003, (德文)
- ^ 引用錯誤:沒有為名為
Ralf的參考文獻提供內容
