二氧化钌
| 二氧化钌 | |
|---|---|
| |
| IUPAC名 Ruthenium(IV) oxide | |
| 别名 | 氧化钌(IV) |
| 识别 | |
| CAS号 | 12036-10-1 |
| PubChem | 82848 |
| SMILES |
|
| InChI |
|
| EINECS | 234-840-6 |
| 性质 | |
| 化学式 | RuO2 |
| 摩尔质量 | 133.0688 g·mol⁻¹ |
| 外观 | 深蓝色固体 |
| 密度 | 6.97 g/cm3 |
| 沸点 | 1200 °C(1473 K) |
| 溶解性(水) | 不可溶 |
| 磁化率 | +162.0·10−6 cm3/mol |
| 结构 | |
| 晶体结构 | 金红石(四方),tP6 |
| 空间群 | P42/mnm, No. 136 |
| 配位几何 | 八面体型 (RuIV),平面三角形 (O2−) |
| 危险性 | |
| 闪点 | 不可燃 |
| 相关物质 | |
| 其他阴离子 | 二硫化钌 |
| 其他阳离子 | 二氧化锇 |
| 相关化学品 | 四氧化钌 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
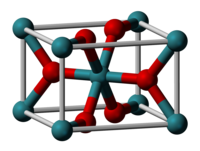
二氧化钌是一种无机化合物,化学式 RuO2。这种黑色固体是钌最常见的氧化物。它用于电催化,合成氯气和氯的氧化物。[1] 类似很多二氧化物, RuO2 为金红石 结构。[2][3]
制备[编辑]
二氧化钌可以由氧化三氯化钌而成。几乎整比的 RuO2 晶体可以由化学气相运输而成,运输剂为 O2:[4]
- RuO2 + O2 ⇌ RuO4
用处[编辑]
二氧化钌是Sumitomo-Deacon反应的催化剂。这个反应通过氧化氯化氢 来得到氯气。[5][6]
参考资料[编辑]
- ^ Mills, A. "Heterogeneous redox catalysts for oxygen and chlorine evolution" Chem. Sot. Rev.,1989, 18, 285-316. doi:10.1039/CS9891800285
- ^ Wyckoff, R.W.G.. Crystal Structures, Vol. 1. Interscience, John Wiley & Sons: 1963.
- ^ Template:Wells4th
- ^ Harald Schäfer, Gerd Schneidereit, Wilfried Gerhardt "Zur Chemie der Platinmetalle. RuO2 Chemischer Transport, Eigenschaften, thermischer Zerfall" Z. anorg. allg. Chem. 1963, 319, 327-336. doi:10.1002/zaac.19633190514
- ^ Helmut Vogt, Jan Balej, John E. Bennett, Peter Wintzer, Saeed Akbar Sheikh, Patrizio Gallone "Chlorine Oxides and Chlorine Oxygen Acids" in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH. doi:10.1002/14356007.a06_483
- ^ Seki, K; Catal. Surv. Asia, 2010, 14, 168 doi:10.1007/s10563-010-9091-7.
外部链接[编辑]
| 维基共享资源上的相关多媒体资源:二氧化钌 |
| |||||||
