離子鍵
此條目沒有列出任何參考或來源。 (2019年3月13日) |
此條目可參照英語維基百科相應條目來擴充。 |
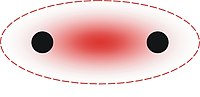
離子鍵又被稱為鹽鍵,是化學鍵的一種,通過兩個或多個原子或化學基團失去或獲得電子而成為離子後形成。帶相反電荷的原子或基團之間存在靜電吸引力,兩個帶相反電荷的原子或基團靠近時,周圍水分子被釋放為自由水中,帶負電和帶正電的原子或基團之間產生的靜電吸引力以形成離子鍵。是離子化合物中發生的主要相互作用。它是與共價鍵和金屬鍵一起的主要鍵合類型之一。
此類化學鍵往往在金屬與非金屬間形成。失去電子(形成陽離子/正離子)的往往是金屬元素的原子,而獲得電子(形成陰離子/負離子)的往往是非金屬元素的原子。帶有相反電荷的離子因電磁力而相互吸引,從而形成化學鍵。離子鍵較氫鍵強,其強度與共價鍵接近。
僅當總體的能階下降的時候,反應才會發生(由化學鍵聯接的原子較自由原子有著較低的能階)。下降越多,形成的鍵越強。
現實中,原子間並不形成「純」離子鍵(即:其中一個原子或分子將電子完全轉移給另一個)。所有的鍵都或多或少帶有共價鍵的成分。成鍵原子之間電平均程度越高,離子鍵成分越低。
一般說來,以離子鍵鍵合的化合物(即「離子化合物」)在固態下不導電,在液態下或形成溶液後導電;它們的熔點一般比較高——這決定於組成它們的離子的電荷:電荷越高,熔點越高;反之亦然。

|
|
|
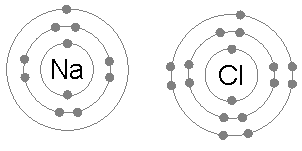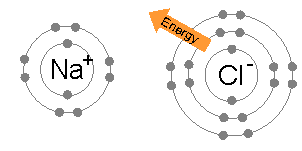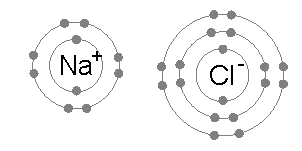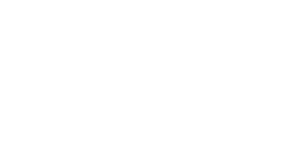
上圖表示鋰原子和氟原子的電子分布。鋰原子只有一個外層電子,原子核對該電子的束縛十分弱(表現為其第一游離能很小)。而氟原子有7個外層電子。如果鋰原子的外層電子進入氟原子的外層軌域,則兩個原子就都有了類似惰性氣體原子的電子分布。鍵能(源自兩個帶有相反電荷的離子因的電磁力的吸引作用)的存在(其值為負數)使得成鍵後的總體能量水平低於未成鍵的狀態。 |
兩個離子間的吸引(例如和)形成離子鍵。電子軌域一般不會重疊(因而沒有形成分子軌域),因為兩個離子都達到了最低的能階,而鍵的完全形成(理想狀態下)是因為正負離子間的電磁相互作用。 |
參見
[編輯]
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
|