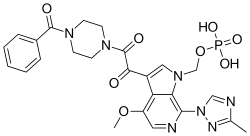
福替沙韦
 | |
 | |
| 臨床資料 | |
|---|---|
| 商品名 | Rukobia |
| 其他名稱 | BMS-663068, GSK3684934 |
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a620046 |
| 核准狀況 | |
| 懷孕分級 | |
| 给药途径 | 口服 |
| ATC碼 | |
| 法律規範狀態 | |
| 法律規範 |
|
| 识别信息 | |
| |
| CAS号 | 864953-29-7 |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| CompTox Dashboard (EPA) | |
| 化学信息 | |
| 化学式 | C25H26N7O8P |
| 摩尔质量 | 583.50 g·mol−1 |
| 3D模型(JSmol) | |
| |
| |
福替沙韦(INN:fostemsavir),商品名Rukobia,是最初由美国百时美施贵宝(BMS)研制的一种HIV-1(艾滋病毒1型)融合抑制剂,用于治疗曾接受过多种抗逆转录病毒药物疗法但因产生多重耐药而治疗失败的HIV感染者[7][4][8]。是首个HIV-1的附着抑制剂药物[9][10]。
其常见的一般不良反应为恶心[4][8][11]。严重不良反应包括乙肝和丙肝的患者的肝酶升高,以及出现免疫重建炎症综合征[8]。
福替沙韦在美国新药申请得到FDA授予突破性治疗药物[註 1]资格[12],并得到快速通道审评待遇。2020年7月2日,FDA批准福替沙以Rukobia商品名上市[7][8][11][10],随后于2021年2月通过欧盟批准[5]。
用法
[编辑]福替沙韦与其他抗逆转录病毒药物联合使用,用于治疗已接受抗病毒药物治疗而产生多重耐药性HIV-1感染成人患者,或因药物不耐受性或安全性问题而不能进行抗病毒药物治疗的HIV-1感染成人患者[10][7]。
不良反应
[编辑]一般常见的不良反应为恶心,罕有腹泻、腹痛、头痛、皮疹、消化不良、睡眠障碍、嗜睡和呕吐现象[4][8][11]。
和其他市面上治疗HIV-1感染药物类似,福替沙韦可能会造成一种名为免疫重建炎症综合征的严重不良反应。这种不良反应可产生于治疗伊始,此时免疫系统可能会变得更强,并开始对抗长期隐藏在体内的感染。其他严重不良反应还包括QT间期延长。对于合并乙肝或丙肝感染的HIV患者,可能会出现肝酶暴增的严重不良反应[11]。
作用机制
[编辑]福替沙韦为替米沙韦(Temsavir)的前药[13],服药后在体内转化为具有活性的替米沙韦,替米沙韦与HIV-1包膜糖蛋白gp120亚基结合,抑制病毒与CD4+T细胞表面受体的相互作用,阻止病毒附着到宿主免疫细胞,预防了随后病毒经膜融合进入宿主细胞内进行复制过程[7],即起HIV-1的附着抑制剂作用[9][10]。
历史
[编辑]福替沙韦最初由百时美施贵宝研发,2014年12月28日被ViiV医药保健公司[註 2]以14亿美元收购百时美施贵宝全部在研艾滋病药物[7],并由ViiV继续对福替沙韦进行研发。研究者发现其转化为替米沙韦的活性形式后能与细胞膜上的gp120蛋白结合,阻碍了HIV与宿主细胞CD4+T细胞的首次接触从而使得病毒不能进入宿主细胞,意味着这是一种全新的HIV药物作用机制[14]。
因为福替沙韦的作用靶点涉及HIV生命周期的多个阶段,对现有抗病毒药物产生耐药的HIV患者提供了新的方案[15]。且福替沙韦对gp120的作用高度保守,因此该药不太可能促进对自身的耐药性[16]。研究者发现,对恩夫韦地和伊巴珠单抗的产生耐药的HIV包膜仍对福替沙韦敏感;相反,对福替沙韦产生耐药的HIV对其他融合抑制剂仍然敏感。此外,对于不需要通过CD4受体来进入宿主细胞的HIV分离株也对福替沙韦敏感,而且病毒不会通过变成CD4非依赖感染方式来逃避福替沙韦的附着抑制作用。之前的体外研究表明福替沙韦对CCR5嗜性HIV和CXCR4嗜性HIV毒株也有抑制效果[14]。

一项III期临床试验(NCT02362503)评估了每日两次口服福替沙韦的安全性和有效性,并在《新英格兰医学杂志》发表结果[17]。这个实验在北美、南美、欧洲、澳大利亚、台湾和南非共23个国家,108个实验点开展,受试对象为371名先前接受过抗逆转录药物治疗但血液中病毒RNA载量仍很高的成年HIV患者,71%的受试者HIV治疗史超15年,在参加实验前已接触过五种不同或更多的HIV治疗方案(占85%)和/或有艾滋病史(占86%)。在实验中,272人为主试验臂(随机队列),其余99人在不同的实验臂(非随机队列)[註 3]中接受福替沙韦治疗 。主试验组的受试者除了已失败的抗逆转录病毒方案外,还接受每日两次的福替沙韦或安慰剂治疗,持续八天。在第八天接受福替沙韦的受试者相比于安慰剂组,血液中病毒RNA载量显著下降。在第八天后所有的受试者均接受了福替沙韦和其他抗逆转录病毒药物治疗,经过24周后,53%的受试者实现了对病毒RNA复制的抑制,使得HIV水平低于检测下限,96周后仍有60%的受试者维持对病毒RNA的抑制。[8][11][18]
2019年12月5日,ViiV公司向FDA递交福替沙韦新药上市申请,并获FDA突破性治疗药物(又称首创新药,first-in-class medication)认证,并得到快速通道、优先审评的特殊待遇[8][7][12]。随后于2020年7月2日通过批准ViiV公司以商品名Rukobia上市[8][11][10]。
VIiV公司同时也向欧盟递交了上市申请。2020年10月10,欧洲药品管理局的人用药品委员会(CHMP)对此申请给出了积极意见,并建议授予药品Rukobia的在欧盟的营销许可,旨在治疗多重耐药性HIV-1感染[19]。并最终于2021年2月获批[5]。
注释
[编辑]参考文献
[编辑]- ^ 1.0 1.1 Rukobia. Therapeutic Goods Administration (TGA). 23 July 2021 [5 September 2021]. (原始内容存档于2021-09-05).
- ^ Notice: Multiple Additions to the Prescription Drug List (PDL) [2022-01-24]. Health Canada. 24 January 2022 [28 May 2022]. (原始内容存档于2022-05-29).
- ^ Summary Basis of Decision (SBD) for Rukobia. Health Canada. 23 October 2014 [29 May 2022]. (原始内容存档于2022-05-29).
- ^ 4.0 4.1 4.2 4.3 Rukobia- fostemsavir tromethamine tablet, film coated, extended release. DailyMed. 2 July 2020 [14 July 2020]. (原始内容存档于2020-07-15).
- ^ 5.0 5.1 5.2 Rukobia EPAR. European Medicines Agency (EMA). 9 December 2020 [12 February 2021]. (原始内容存档于2021-02-12).
- ^ Rukobia Product information. Union Register of medicinal products. [3 March 2023].
- ^ 7.0 7.1 7.2 7.3 7.4 7.5 陈本川. 治疗人类免疫缺陷病毒Ⅰ型多重耐药性新药——福替沙韦缓释片(fostemsavir extended-release tablets). 医药导报. 2021, 40 (3): 425-435.
- ^ 8.0 8.1 8.2 8.3 8.4 8.5 8.6 8.7 FDA Approves New HIV Treatment for Patients With Limited Treatment Options. U.S. Food and Drug Administration (新闻稿). 2 July 2020 [2 July 2020]. (原始内容存档于2020-07-03).
 本文含有此來源中屬於公有领域的内容。
本文含有此來源中屬於公有领域的内容。
- ^ 9.0 9.1 王珺,展鹏. 新型HIV-1附着抑制剂fostemsavir. 中国感染与化疗杂志. 2022, 22 (6): 755-761. doi:10.16718/j.1009-7708.2022.06.017.
- ^ 10.0 10.1 10.2 10.3 10.4 ViiV Healthcare Announces US FDA Approval for Rukobia (fostemsavir), a First-in-Class Treatment for HIV in Adults With Few Treatment Options Available (新闻稿). ViiV Healthcare. 2 July 2020 [2 July 2020]. (原始内容存档于2020-07-03) –通过Business Wire.
- ^ 11.0 11.1 11.2 11.3 11.4 11.5 Drug Trials Snapshots: Rukobia. U.S. Food and Drug Administration (FDA). 2 July 2020 [14 July 2020]. (原始内容存档于2020-07-31).
 本文含有此來源中屬於公有领域的内容。
本文含有此來源中屬於公有领域的内容。
- ^ 12.0 12.1 New Drug Therapy Approvals 2020. U.S. Food and Drug Administration (FDA). 31 December 2020 [17 January 2021]. (原始内容存档于2021-01-18).
 本文含有此來源中屬於公有领域的内容。
本文含有此來源中屬於公有领域的内容。
- ^ Lai YT, Wang T, O'Dell S, Louder MK, Schön A, Cheung CS, et al. Lattice engineering enables definition of molecular features allowing for potent small-molecule inhibition of HIV-1 entry. Nature Communications. January 2019, 10 (1): 47. Bibcode:2019NatCo..10...47L. PMC 6318274
 . PMID 30604750. doi:10.1038/s41467-018-07851-1.
. PMID 30604750. doi:10.1038/s41467-018-07851-1.
- ^ 14.0 14.1 Highleyman L. HIV Attachment Inhibitor BMS-663068 Looks Good in Early Studies. HIVandHepatitis.com. 4 September 2012 [28 May 2014]. (原始内容存档于2 June 2021).
- ^ Highleyman L. HIV attachment inhibitor BMS-663068 shows good safety and efficacy in phase 2b study. AidsMap. NAM. 6 March 2014 [2024-09-01]. (原始内容存档于2018-11-01).
- ^ Li Z, Zhou N, Sun Y, Ray N, Lataillade M, Hanna GJ, Krystal M. Activity of the HIV-1 attachment inhibitor BMS-626529, the active component of the prodrug BMS-663068, against CD4-independent viruses and HIV-1 envelopes resistant to other entry inhibitors. Antimicrobial Agents and Chemotherapy. September 2013, 57 (9): 4172–80. PMC 3754311
 . PMID 23774428. doi:10.1128/AAC.00513-13.
. PMID 23774428. doi:10.1128/AAC.00513-13.
- ^ Michael Kozal, M.D., Judith Aberg, M.D., Gilles Pialoux, M.D., Pedro Cahn, M.D.; et al. Fostemsavir in Adults with Multidrug-Resistant HIV-1 Infection. The New England Journal of Medicine. 2020, 382 (13): 1232-1243. doi:10.1056/NEJMoa1902493.
- ^ Fostemsavir治疗多药耐药HIV-1感染者疗效显著. 中国科学报社. 2020-03-30 [2024-09-01]. (原始内容存档于2024-09-01).
- ^ Rukobia: Pending EC decision. European Medicines Agency (EMA). 11 December 2020 [11 December 2020]. (原始内容存档于12 December 2020). Text was copied from this source which is copyright European Medicines Agency. Reproduction is authorized provided the source is acknowledged.
延伸阅读
[编辑]- Kozal M, Aberg J, Pialoux G, Cahn P, Thompson M, Molina JM, et al. Fostemsavir in Adults with Multidrug-Resistant HIV-1 Infection. The New England Journal of Medicine. March 2020, 382 (13): 1232–1243. PMID 32212519. doi:10.1056/NEJMoa1902493
 .
.
外部链接
[编辑]- Clinical trial number NCT02362503 for "Attachment Inhibitor Comparison in Heavily Treatment Experienced Patients" at ClinicalTrials.gov
