铬酸钠
| 铬酸钠 | |
|---|---|
| |

| |
| IUPAC名 Sodium chromate | |
| 英文名 | Sodium chromate |
| 识别 | |
| CAS号 | 7775-11-3 |
| PubChem | 24488 |
| SMILES |
|
| InChI |
|
| UN编号 | 3288 |
| EINECS | 231-889-5 |
| ChEBI | 78671 |
| RTECS | GB2955000 |
| 性质 | |
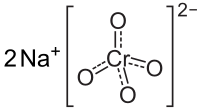
| 化学式 | Na2CrO4 |
| 摩尔质量 | 161.97 g·mol⁻¹ |
| 外观 | 黄色晶体 |
| 密度 | 2.723 g/cm3 |
| 熔点 | 792 °C |
| 溶解性(水) | 44.3%, 20 °C 56.1%, 100 °C |
| 结构 | |
| 晶体结构 | 正交 413 °C以上为六方 |
| 热力学 | |
| ΔfHm⦵298K | −1329 kJ/mol |
| 危险性 | |
| 警示术语 | R:R45, R46, R60, R61, R21, R25, R26, R34, R42/43, R48/23, R50/53 [1] |
| 安全术语 | S:S53, S45, S60, S61 [1] |
| 主要危害 | 致癌性 |
| 相关物质 | |
| 其他阴离子 | 钼酸钠 钨酸钠 |
| 其他阳离子 | 铬酸钾 |
| 相关化学品 | 重铬酸钠 三氧化铬 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
4(Mg0 • Crz03) + 8NazCOs + 60,= 8.NazCr04+ 4MgO + 8C02
铬酸钠(化学式:Na2CrO4)是一种黄色固体,是铬酸形成的钠盐。铬酸钠用作石油工业中的腐蚀抑制剂、织物的染料助剂及木材防腐剂,[2]在医药学中也有应用。[3]它可由重铬酸钠与氢氧化钠反应制备,具潮解性,可生成四水、六水和十水合物。
性质[编辑]
水溶液中它与重铬酸钠存在平衡,加酸有利于红色重铬酸钠的生成:
- 2 CrO42− + 2 H3O+ ⇌ Cr2O72− + 3 H2O
毒性[编辑]
制备[编辑]
1.采用中和法。将重铬酸钠碱性液加入中和器。再加入重铬酸钠母液进行中和反应,经过滤、澄清、冷却结晶,制得铬酸钠成品。
2.以铬铁矿(Fe、Mg)O·(Cr 、Al、Fe)2O3为原料,在强氧化剂存在下用碱分解矿石。氧化焙烧在管式炉中进行,温度1100~1200℃。当炉料加热至不太高的温度 (600~800℃)时,便开始生成铬酸钠。待温度升至接近1000℃时,铬酸钠的生成速度增大。反应原理可以下列方程式近似地表示。
4(Fe0 • Cr203) + 8 NazCO3 + 702=8Nar Cr04+ 2FerOs +8C02
4(Mg0 • Crz03) + 8NazCO3+ 60=8NazCr04+ 4MgO + 8C02
反应过程中产生的副产物 ( 亚铁酸钠、铝酸钠及硅酸钠等)又与铬铁矿、石灰及氧反应,生成铬酸钠及不溶的钙化物,因而该方法的产率较高 (75%~81%) 。一种改进的方法是,先在1000℃下焙烧铬铁矿和添加剂氧化钙,生成亚铬酸 铬酸钙 (CaO·4CrO3·Cr2O3) ,然后再加入纯碱,于600~700℃使与亚铬酸 铬酸钙反应,生成铬酸钠和少量其他副产物。用水浸取处理,再向水溶液中通入CO2,将形成的Ca(OH)2变成CaCO3沉淀出来,而生成的CaCrO4 再与纯碱反应而生成NaCrO。[3]
参见[编辑]
参考资料[编辑]
- ^ 1.0 1.1 1.2 SODIUM CHROMATE. inchem. [2008-06-20]. (原始内容存档于2002-06-20).
- ^ Sodium chromate - Pesticide use statistics for 2005. PAN Pesticides Database. [2008-06-20]. (原始内容存档于2007-09-28).
- ^ 3.0 3.1 Bracco Diagnostics Inc. chromitope sodium (Sodium Chromate, Cr 51) injection, solution. DailyMed. [2008-06-20]. (原始内容存档于2009-05-14).
- ^ Record in the GESTIS Substance Database from the IFA, accessed on 2008-06-20
- Gerd Anger, Jost Halstenberg, K
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
