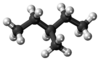
3-甲基戊烷,是五个一结构异构体的己烷,也是分子式为 的支链烷烃,是在正戊烷的第三个碳原子上的氢被甲基取代,所形成的己烷的结构异构体。
的支链烷烃,是在正戊烷的第三个碳原子上的氢被甲基取代,所形成的己烷的结构异构体。
由IUPAC命名法指定的“3-甲基戊烷”
“3-甲基”表示一颗碳原子与主干第三个碳相接
“戊烷”表示主干上有五个碳
3-甲基戊烷在快速干燥涂料,印刷油墨和粘合剂中作为稀释剂
此外,它也可用于在燃料,润滑剂[3]
化合物也用作光谱学和色谱法中的参考物质[4]
3-甲基戊烷形成高度易燃的蒸汽 - 空气混合物
该化合物的闪点低于-20℃
以上所述的爆炸范围是1.2之间体积%(40克/米3)[5]比爆炸下限(LEL)和7.0%(体积)(250克/米3)作为爆炸上限(UEL)[6]
所述的点火温度为300℃ 所述的织物因而落入内温度类 T3。
3-甲基戊烷是可燃的,易挥发的无色液体,苯酚气味
在1大气压下,该化合物的沸点为63℃
该蒸气压力函数由下式给出log10(P) = A−(B/(T+C))( P是巴(bar),T是凯氏温标(K) )
其中A = 3.97377 B = 1152.368和C = -46.021的温度范围内289K至337K [7]
最重要的热力学性质列于下表:
| 属性
|
单位
|
数值
|
| 标准焓
|
ΔfH0gas
|
−171,6 kJ·mol−1[8]
|
| 标准摩尔熵
|
S0liquid
S0g
|
292,5 J·mol−1·K−1[9] 液体
382,88 J·mol−1·K−1[9] 气体
|
| 燃烧热
|
ΔcH0liquid
|
−4159,98 kJ·mol−1[9]
|
| 热容量
|
cp
|
191,16 J·mol−1·K−1 (25 °C)[10]液体
|
| 熔融焓
|
ΔfH0
|
5,3032 kJ·mol−1[9]在熔点
|
| 融化
|
ΔfS0
|
48,101 kJ·mol−1[9]在熔点
|
| 蒸发
|
ΔVH0
|
28,08 kJ·mol−1[11]在常压下的沸点
30,47 kJ·mol−1[12] 在25℃下
|
| 临界温度
|
TC
|
231 °C[13]
|
| 临界压力
|
PC
|
31,1 bar[13]
|
| 临界体积
|
VC
|
0,368 l·mol−1[13]
|
| 临界密度
|
ρC
|
2,72 mol·l−1[13]
|
蒸发焓的温度依赖性可以根据等式
ΔVH0=A·exp(−β·Tr)(1−Tr)β (ΔVH0 的单位是kJ/mol,Tr =(T/Tc)降低温度),在298K和353K之间的温度范围内, A = 45,24 kJ/mol, β = 0,2703 und Tc = 504,4 K[14]
3-甲基戊烷是一种无色液体,具有微弱的特殊气味(苯酚味)
C6H12显示出了4个异构体:
- 己烷(正己烷):CH3(CH2)4CH3
- 2-甲基戊烷(异己烷):CH3CH2CH2CH(CH3)2
- 2,2-二甲基丁烷(新己烷):CH3CH2C(CH3)3
- 2,3-二甲基丁烷:(CH3)2 CHCH(CH3)2
| 结构式
|
名称
|
分子量
|
沸点(°C, 1 atm)
|
结构简式
|
|
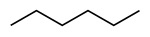
正己烷
己烷
|
86,18
|
69
|
CH3(CH2)4CH3
|
|
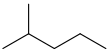
2-甲基戊烷
异己烷
|
58,12
|
60
|
(CH3)2CH(CH2)2CH3
|
|
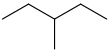
3-甲基戊烷
|
58,12
|
64
|
CH3CH2CH(CH3)CH2CH3
|
|
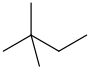
2,2-二甲基丁烷
新己烷
|
58,12
|
49,73
|
CH3C(CH3)2CH2CH3
|
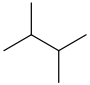
|
2,3-二甲基丁烷
|
58,12
|
57,9
|
CH3CH(CH3)CH(CH3)CH3
|
- 从石油分离
- 从石油精炼或聚合烃得到的混合物中分离
在催化剂 如:三氯化磷存在下,在400℃和200巴下使正丁烷与乙烯的反应可以制造3-甲基戊烷[15]
![{\displaystyle \mathrm {CH_{3}CH_{2}CH_{2}CH_{3}+C_{2}H_{4}{\xrightarrow[{400^{o}C,200bar}]{PCl_{3}}}CH_{3}CH_{2}CH(CH_{3})CH_{2}CH_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/279f4043380cba97f2b53b52c307db19ff96672f)
- 结构上,3-甲基戊烷由二部分组成:丁烷()和乙烷(
 )。
)。
因此,制备纯3-甲基戊烷的最简单的方法是:[16]
1.仲丁基卤化物 与 乙基锂 或 丁基锂 与 乙基卤化物 反应


或


2.武慈(Wurtz)反应可以得到该产品的混合物:[17]
- 产生氢,即金属+酸(H+):[18]

或

或

或

2. 氢化铝锂(LiAlH4) 或 硼氢化钠(NaBH4):[19]

或

或

或

3. 使用碘化氢(HI)还原烷基碘:[20]

或

或

或

4. 使用甲硅烷(SiH4)中还原烷基卤化物,在三氟化硼的催化下制备丁烷:[21]

或

或

或

5. 使用烷基锡烷还原烷基卤化物:[22]

或

或

或

6.金属的还原,得到水解的有机金属化合物:
使用锂(Li):[23]
![{\displaystyle \mathrm {CH_{3}CH_{2}CH(CH_{3})CH_{2}CH_{2}X+2Li{\xrightarrow[{-10^{o}C}]{|Et_{2}O|}}CH_{3}CH_{2}CH(CH_{3})CH_{2}CH_{2}Li+LiX} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/35a01d618e6db233645a6620125e2bdbff5ac755)

![{\displaystyle \mathrm {CH_{3}CH_{2}CH(CH_{3})CHXCH_{3}+2Li{\xrightarrow[{-10^{o}C}]{|Et_{2}O|}}CH_{3}CH_{2}CH(CH_{3})CHLiCH_{3}+LiX} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/7acf32fe22be182bd91b84ca9099cd6a14c9a940)

![{\displaystyle \mathrm {CH_{3}CH_{2}CX(CH_{3})CH_{2}CH_{3}+2Li{\xrightarrow[{-10^{o}C}]{|Et_{2}O|}}CH_{3}CH_{2}CLi(CH_{3})CH_{2}CH_{3}+LiX} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/85d39372d9d6328522ca5a237f130e7b184d6f9e)

![{\displaystyle \mathrm {(CH_{3}CH_{2})_{2}CHCH_{2}X+2Li{\xrightarrow[{-10^{o}C}]{|Et_{2}O|}}(CH_{3}CH_{2})_{2}CHCH_{2}Li+LiX} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/4a573289597ce5fa285aba6f5e302edd128267d6)

使用镁(Mg):[24]








1. 3-甲基-1-戊烯:[25]

2. 3-甲基-2-戊烯:[25]

3. 2-乙基-1-丁烯:[25]

4. 3-甲基-1,2-戊二烯:[25]

5. 3-甲基-1,3-戊二烯:[25]

6. 3-甲基-1,4-戊二烯:[25]

7. 3-甲基戊烷-1:[26]

8. 3-甲基-1,2,4-戊二烯:[25]

9. 3-甲基-4-戊烯-2-炔:[25][26]

10. 3-甲基-4-戊烯-1-炔:[25][26]

3-甲基戊醛:

甲基丁醛:

3-甲基戊酮

1.还原硫醇可以产生3-甲基戊烷。
例如 通过还原 3-甲基-1-戊硫醇 (雷尼镍催化):[29]

2.还原硫酯可以产生3-甲基戊烷..
例如 通过还原 二(3-甲基戊基)硫醚(雷尼镍催化):[30]

加热碱性的 4-甲基己酸溶液 [CH3CH2CH(CH3)CH2CH2COOH] [31]
或 2,3-二甲基戊酸 [CH3CH2CH(CH3)CH(CH3)COOH]
或 2-乙基-2-甲基丁酸 [CH3CH2C(CH3)(CH2CH3)COOH]
或 3-乙基戊酸 [(CH3)2CHCH2CH2COOH]
1.完全燃烧:就像所有的烷烃一样,3-甲基戊烷与过量的氧气燃烧,产生二氧化碳和水:[32]

2.水煤气:
![{\displaystyle \mathrm {C_{6}H_{14}+6H_{2}O{\xrightarrow[{700-1100^{o}C}]{Ni}}6CO+14H_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/bc614cb06d25d60002976e6ab05e54a5f6b11e11)
3.催化氧化的主要产物为3-甲基戊醇-3:
![{\displaystyle \mathrm {CH_{3}CH_{2}CH(CH_{3})CH_{2}CH_{3}+{\frac {1}{2}}O_{2}{\xrightarrow[{\triangle }]{Cu}}CH_{3}CH_{2}C(OH)(CH_{3})CH_{2}CH_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/a4265be986ab6c8fb4319bf6e77ddc2749322b63)
4.使用高锰酸钾(KMnO4)氧化的产物为3-甲基戊醇-3:

![{\displaystyle \mathrm {CH_{3}CH_{2}CH(CH_{3})CH_{2}CH_{3}+X_{2}{\xrightarrow[{\triangle }]{UV}}aCH_{3}CH_{2}CH(CH_{3})CH_{2}CH_{2}X+bCH_{3}CH_{2}CH(CH_{3})CHXCH_{3}+cCH_{3}CH_{2}CX(CH_{3})CH_{2}CH_{3}+dCH_{3}CH_{2}CH(CH_{2}X)CH_{2}CH_{3}+HX} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/a45033260e6d448a148524da1549c2330221fcb5)
CH3CH2CH(CH3)CH2CH3的氯化分析:
[编辑]- 参见:统计学
- 1.发生:自由基生产
![{\displaystyle \mathrm {Cl_{2}{\xrightarrow[{\triangle }]{UV}}2Cl^{\bullet }-239kJ} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/73fe9c8e7397e9e50d5b5a7ea91a25e26bed2f96)
- 所需要的能量从紫外光(UV)或热(D)吸收
- 2.扩散:消耗旧自由基,形成新的自由基





- 3.终止:自由基在罕见的情况下消耗[37]







 [38]
[38]

- 然而,在制造单卤化物时,实际上难以停止反应,如果使用等摩尔量的CH3CH2CH(CH3)CH2CH3和X2 则将产生CH3CH2CH(CH3)CH2CH3的全部卤素衍生物的混合物
- 如果使用过量的CH3CH2CH(CH3)CH2CH3,则单一衍生物的产率,由于与自由基遇到和X的几率相关的CH2CH2CH(CH3)CH2CH3(CH3)2的统计几率的增加而大大增加
- 导致剩余的X衍生物的生产
- 碳烯(例如[:CH2])反应是极少消耗的,可以插入C-H键。 例如 :[39]

- 碳烯在六键 CH-1,5- 2 -h:6
- 碳烯在四键 2,4-CH-H:4
- 插键CH:1
- 三个插入物(3)链路CH-1' 2 -H):4。
- 因此,存在3-甲基己烷(〜43%),2,3-二甲基戊烷(〜29%),3,3-二甲基戊烷(〜7%)和乙基戊烷(-29%)的混合物
与硝酸(HNO3)的蒸气反应:[40]

其中0 <A,B,C,D <1,A + B + C + D = 1
3-甲基戊烷可以在 (CH3CH2)2Cs-(CH3)-Hs+的含义内产生多个键合反应。如:[41]
![{\displaystyle \mathrm {(CH_{3}CH_{2})_{2}CHCH_{3}+RCH=CH_{2}{\xrightarrow[{0^{o}C}]{HF}}(CH_{3}CH_{2})_{2}C(CH_{3})CH(R)CH_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/5f2c4d492968512540fac1463736dd4a348634ce)
2-甲基戊烷可经催化异构化变成己烷,2,2-二甲基丁烷(新己烷)和2,3-二甲基丁烷:

- ^ 3-methylpentane - Compound Summary. PubChem Compound. USA: National Center for Biotechnology Information. Identification and Related Records. 26 March 2005 [5 March 2012].
- ^ NIOSH Pocket Guide to Chemical Hazards. #0323. NIOSH.
- ^ 3-Methylpentan (Enius). [2017-08-24]. (原始内容存档于2020-02-22).
- ^ Entry on Methylpentane. at: Römpp Online. Georg Thieme Verlag, retrieved 16. Juni 2014.
- ^ E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen – Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- ^ E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen – Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- ^ C. B. Williamham, W. J. Taylor, J. M. Pignocco, F. D. Rossini: Vapor Pressures and Boiling Points of Some Paraffin, Alkylcyclopentane, Alkylcyclohexane, and Alkylbenzene Hydrocarbons, in: J. Res. Natl. Bur. Stand. (U.S.), 1945, 35, S. 219–244.
- ^ E. J. Prosen, F. D. Rossini: Heats of combustion and formation of the paraffin hydrocarbons at 25 °C, in: J. Res. Natl. Bur. Stand. (U.S.), 1945, 35, S. 263–267.
- ^ 9.0 9.1 9.2 9.3 9.4 H. L. Finke, J. F. Messerly: 3-Methylpentane and 3-methylheptane: low-temperature thermodynamic properties, in: J. Chem. Thermodyn., 1973, 5, S. 247–257, doi:10.1016/S0021-9614(73)80085-0.
- ^ K. Ohnishi, I. Fujihara, S. Murakami: Thermodynamic properties of decalins mixed with hexane isomers at 298.15K. 1. Excess enthalpies and excess isobaric heat capacities, in: Fluid Phase Equilib., 1989, 46, S. 59–72, doi:10.1016/0378-3812(89)80275-4.
- ^ V. Majer, V. Svoboda: Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation, Blackwell Scientific Publications, Oxford, 1985, S. 300.
- ^ I. Wadso: A heat of vaporization calorimeter for work at 25 °C and for small amounts of substances, in: Acta Chem. Scand., 1966, 20, S. 536–543, doi:10.3891/acta.chem.scand.20-0536.
- ^ 13.0 13.1 13.2 13.3 T. E. Daubert: Vapor-Liquid Critical Properties of Elements and Compounds. 5. Branched Alkanes and Cycloalkanes, in: J. Chem. Eng. Data, 1996, 41, S. 365–372, doi:10.1021/je9501548.
- ^ V. Majer, V. Svoboda: Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation, Blackwell Scientific Publications, Oxford, 1985, S. 300.
- ^ A. A. O’Kelly, A. N. Sachanen: Alkylation of Paraffins in the Presence of Homogeneous Catalysts. synthesis of Neohexane and Triptane, in: Ind. Eng. Chem., 1946, 38, S. 462–467, doi:10.1021/ie50437a010.
- ^ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 187, §7.3.5
- ^ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.2β, R = CH3CH2, R' = CH3CH2CH2CHCH3
- ^ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.1β., με R = CH3CH2CH(CH3)CH2CH2 ή CH3CH2CH2CH(CH3)CHCH3 ή CH3CH2C(CH3)CH2CH3 ή (CH3CH2)2CΗCH2
- ^ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, §6.2.1α., με R = CH3CH2CH(CH3)CH2CH2 ή CH3CH2CH2CH(CH3)CHCH3 ή CH3CH2C(CH3)CH2CH3 ή (CH3CH2)2CΗCH2
- ^ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ.14, §1.1
- ^ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ. 291-293, §19.1.
- ^ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, Σελ. 42, §4.3.
- ^ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ.80-82, §5.1-5.2
- ^ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.4α., με R = CH3CH2CH(CH3)CH2CH2 ή CH3CH2CH2CH(CH3)CHCH3 ή CH3CH2C(CH3)CH2CH3 ή (CH3CH2)2CΗCH2
- ^ 25.0 25.1 25.2 25.3 25.4 25.5 25.6 25.7 25.8 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.5.
- ^ 26.0 26.1 26.2 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.4α.
- ^ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.7.6β.
- ^ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.7.6α, R = CH3, R' = CH3CH2CH2CH(CH3)2
- ^ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.269, §11.6B7.
- ^ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.269, §11.6B7.
- ^ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.3α., με R = CH3CH(CH3)CH2CH2 ή CH3CH2CH(CH3)CHCH3 ή CH3CH2C(CH3)CH2CH3 ή (CH3CH2)2CHCH3
- ^ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.1, v = 6 και μετατροπή μονάδας ενέργειας σε kJ.
- ^ ΔHC-C= +347 kJ/mol
- ^ ΔHC-H = +415 kJ/mol
- ^ ΔHO-O=+146 kJ/mol
- ^ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.7.1β., με R = CH3CH2CH(CH3)CH2CH2 ή CH3CH2CH2CH(CH3)CHCH3 ή CH3CH2C(CH3)CH2CH3 ή (CH3CH2)2CHCH2
- ^ καθοριστικό ταχύτητας}
- ^ 不因空间位置阻碍进行
- ^ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3, R = CH3CH2CH(CH3)CH2CH2 ή CH3CH2CH2CH(CH3)CHCH3 ή CH3CH2C(CH3)CH2CH3 ή (CH3CH2)2CHCH2.
- ^ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 244 , §10.3.2, R = CH3CH2CH(CH3)CH2CH2 ή CH3CH2CH2CH(CH3)CHCH3 ή CH3CH2C(CH3)CH2CH3 ή (CH3CH2)2CHCH2.
- ^ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, σελ. 85, §6.3.











![{\displaystyle \mathrm {CH_{3}CH_{2}CH_{2}CH_{3}+C_{2}H_{4}{\xrightarrow[{400^{o}C,200bar}]{PCl_{3}}}CH_{3}CH_{2}CH(CH_{3})CH_{2}CH_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/279f4043380cba97f2b53b52c307db19ff96672f)


























![{\displaystyle \mathrm {CH_{3}CH_{2}CH(CH_{3})CH_{2}CH_{2}X+2Li{\xrightarrow[{-10^{o}C}]{|Et_{2}O|}}CH_{3}CH_{2}CH(CH_{3})CH_{2}CH_{2}Li+LiX} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/35a01d618e6db233645a6620125e2bdbff5ac755)

![{\displaystyle \mathrm {CH_{3}CH_{2}CH(CH_{3})CHXCH_{3}+2Li{\xrightarrow[{-10^{o}C}]{|Et_{2}O|}}CH_{3}CH_{2}CH(CH_{3})CHLiCH_{3}+LiX} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/7acf32fe22be182bd91b84ca9099cd6a14c9a940)

![{\displaystyle \mathrm {CH_{3}CH_{2}CX(CH_{3})CH_{2}CH_{3}+2Li{\xrightarrow[{-10^{o}C}]{|Et_{2}O|}}CH_{3}CH_{2}CLi(CH_{3})CH_{2}CH_{3}+LiX} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/85d39372d9d6328522ca5a237f130e7b184d6f9e)

![{\displaystyle \mathrm {(CH_{3}CH_{2})_{2}CHCH_{2}X+2Li{\xrightarrow[{-10^{o}C}]{|Et_{2}O|}}(CH_{3}CH_{2})_{2}CHCH_{2}Li+LiX} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/4a573289597ce5fa285aba6f5e302edd128267d6)





























![{\displaystyle \mathrm {C_{6}H_{14}+6H_{2}O{\xrightarrow[{700-1100^{o}C}]{Ni}}6CO+14H_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/bc614cb06d25d60002976e6ab05e54a5f6b11e11)
![{\displaystyle \mathrm {CH_{3}CH_{2}CH(CH_{3})CH_{2}CH_{3}+{\frac {1}{2}}O_{2}{\xrightarrow[{\triangle }]{Cu}}CH_{3}CH_{2}C(OH)(CH_{3})CH_{2}CH_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/a4265be986ab6c8fb4319bf6e77ddc2749322b63)

![{\displaystyle \mathrm {CH_{3}CH_{2}CH(CH_{3})CH_{2}CH_{3}+X_{2}{\xrightarrow[{\triangle }]{UV}}aCH_{3}CH_{2}CH(CH_{3})CH_{2}CH_{2}X+bCH_{3}CH_{2}CH(CH_{3})CHXCH_{3}+cCH_{3}CH_{2}CX(CH_{3})CH_{2}CH_{3}+dCH_{3}CH_{2}CH(CH_{2}X)CH_{2}CH_{3}+HX} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/a45033260e6d448a148524da1549c2330221fcb5)
![{\displaystyle \mathrm {Cl_{2}{\xrightarrow[{\triangle }]{UV}}2Cl^{\bullet }-239kJ} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/73fe9c8e7397e9e50d5b5a7ea91a25e26bed2f96)
















![{\displaystyle \mathrm {(CH_{3}CH_{2})_{2}CHCH_{3}+RCH=CH_{2}{\xrightarrow[{0^{o}C}]{HF}}(CH_{3}CH_{2})_{2}C(CH_{3})CH(R)CH_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/5f2c4d492968512540fac1463736dd4a348634ce)
