硫化钾
外观
| 硫化钾 | |
|---|---|
| |

| |
| IUPAC名 Potassium sulfide | |
| 识别 | |
| CAS号 | 1312-73-8 |
| PubChem | 162263 |
| ChemSpider | 142491 |
| SMILES |
|
| RTECS | TT6000000 |
| 性质 | |
| 化学式 | K2S |
| 摩尔质量 | 110.262 g·mol⁻¹ |
| 外观 | 无色晶体 不纯时为黄棕色的固体 |
| 密度 | 1.8 g/cm3 |
| 熔点 | 840 °C |
| 溶解性(水) | 水解为KSH、KOH |
| 溶解性(其他溶剂) | 可溶于乙醇和甘油 |
| 结构 | |
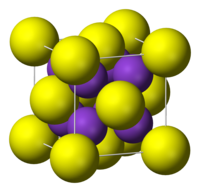
| 晶体结构 | 反萤石型结构 |
| 危险性 | |
| 警示术语 | R:R31, R34 |
| 安全术语 | S:S26, S45 |
| 主要危害 | 有毒 |
| 相关物质 | |
| 其他阴离子 | 氧化钾 硒化钾 碲化钾 钋化钾 |
| 其他阳离子 | 硫化钠、硫化铷、硫化铯、硫化钫 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
硫化钾是一个无机盐类,化学式为K2S。它的晶体结构与硫化锂、硫化钠和硫化铷类似,都为反萤石型结构,半径较小的钾离子占CaF2中的F−位,较大的硫离子占八配位的Ca2+位。[1]
硫化钾与其他碱金属硫化物类同,[1] 含有强碱性的S2−阴离子,溶于水时强烈水解为氢氧化钾和硫化氢钾:
- K2S + H2O → KOH + KSH
实际中通常不需考虑该反应,含SH−与OH−的混合溶液可以作S2−来源。
K2S可由单质钾与硫化合制备。该反应十分剧烈,实验室中常以液态的无水氨作介质。
多硫化钾(K2Sx)是多硫化物的一类,含有多硫离子Sx2−,可由硫溶于硫化钾溶液制备。其颜色随着x值增大而加深,与酸反应放出硫化氢气体,多余的硫沉淀下来。
参考资料
[编辑]- ^ 1.0 1.1 Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
