中心法则
分子生物学的中心法则(英语:The central dogma of molecular biology,又译分子生物学的中心教条),首先由佛朗西斯·克里克于1958年[1]提出,并于1970年[2]在《自然》上的一篇文章中重申:
| “ | The central dogma of molecular biology deals with the detailed residue-by-residue transfer of sequential information. It states that such information cannot be transferred from protein to either protein or nucleic acid. (分子生物学的中心法则旨在详细说明连串信息的逐字传送。它指出遗传信息不能由蛋白质转移到蛋白质或核酸之中。换句话说,遗传信息传到蛋白质后,不能回流到核酸之中。) |
” |

中心法则经常为人误解,尤其与遗传信息“由DNA到RNA到蛋白质”的标准流程相混淆。有些与标准流程不同的信息流被误以为是中心法则的例外,其实朊毒体是中心法则现时已知的唯一例外。
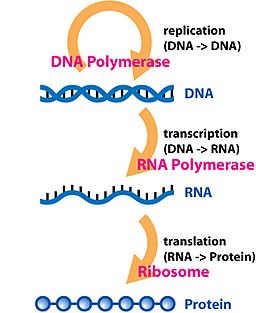
遗传信息的标准流程大致可以这样描述:“DNA制造RNA,RNA制造蛋白质,蛋白质反过来协助前两项流程,并协助DNA自我复制”,或者更简单的“DNA → RNA →蛋白质”。所以整个过程可以分为三大步骤:转录、翻译(蛋白质生物合成)和DNA复制。对于RNA的最新了解,告诉我们还有剪接和编辑。
遗传信息的一般性传递
[编辑]
中心法则是一个框架,用于理解遗传信息在生物大分子之间传递的顺序,对于生物体中三类主要生物大分子:DNA、RNA和蛋白质,有9种可能的传递顺序。法则将这些顺序分为三类,3个一般性的传递(通常发生在大多数细胞中),3个特殊传递(会发生,但只在一些特定条件下发生),3个未知传递(可能不会发生)。
法则中3类遗传信息的传递顺序 一般 特殊 未知 DNA → DNA RNA → DNA 蛋白质→ DNA DNA → RNA RNA → RNA 蛋白质→ RNA RNA →蛋白质 DNA →蛋白质 蛋白质→蛋白质
转录
[编辑]转录(Transcription)是遗传信息由DNA转换到RNA的过程。转录是信使RNA(mRNA)以及非编码RNA(tRNA、rRNA等)的合成步骤。转录中,一个基因会被读取、复制为mRNA;这个过程由RNA聚合酶(RNA polymerase)和转录因子(transcription factor)所共同完成。
编辑
[编辑]RNA编辑(RNA editing)是指在RNA水平上的改变遗传信息的加工过程,导致成熟的RNA编码序列和它的转录模板DNA序列之间的不相匹配。在真核生物的tRNA、rRNA和mRNA中都发现了RNA编辑这种现象。RNA编辑有核苷酸的删除或插入编辑、碱基替换编辑2种类型。这种改变影响了基因的表达,生成不同的氨基酸以及新的开放读码框。编辑可在多种水平被调节,并且与一些人类疾病有一定的相关性。
剪接
[编辑]在真核细胞中,原始转录产物(mRNA前体Pre-mRNA)还要被加工:一个或多个序列(内含子)被剪出除去。选择性剪接的机制使之可产生出不同的成熟的mRNA分子,这取决于哪段序列被当成内含子而哪段又作为存留下来的外显子。并非全部有mRNA的活细胞都要经历这种剪接;剪接在原核细胞中是不存在的。
翻译
[编辑]最终,成熟的mRNA接近核糖体,并在此处被翻译。原核细胞没有细胞核,其转录和翻译可同时进行。而在真核细胞中,转录的场所和翻译的场所通常是分开的(前者在细胞核,后者在细胞质),所以mRNA必须从细胞核转移到细胞质,并在细胞质中与核糖体结合。核糖组会以三个密码子来读取mRNA上的信息,一般是从AUG开始,或是核糖组连接位下游的启始甲硫氨酸密码子开始。启始因子及延长因子的复合物会将氨酰tRNA(tRNAs)带入核糖组-mRNA复合物中,只要mRNA上的密码子能与tRNA上的反密码子配对,即可按照mRNA上的密码序列加入氨基酸。当一个个氨基酸串连成多肽的肽链后,就会开始折叠成正确的构形。这个折叠的过程会一直进行,直到原先的多肽的肽链从核糖组释出,并形成成熟的蛋白质。在一些情况下,新合成的多肽的肽链需要经过额外的处理才能成为成熟的蛋白质。正确的折叠过程是相当复杂的,且可能需要其他称为分子伴侣的帮忙。有时蛋白质本身会进一步被切割,此时内部被“舍弃”的部分即称为内含肽。
DNA复制
[编辑]作为中心法则的最后一步,DNA必须忠实地进行复制才能使遗传密码从亲代转移至子代。复制是由一群复杂的蛋白质完成的;这些蛋白质打开超螺旋结构、DNA双螺旋结构,并利用DNA聚合酶及其相关蛋白,拷贝或复制原模板,以使新代细胞或机体能重复DNA → RNA →蛋白质的过程。 DNA分子存在着构型多样性,在遗传信息的传递和表达过程中,DNA构象存在着左手螺旋及右手螺旋向右手螺旋的转变过程,因此应赋有核酸构象的转换形式。
只有RNA基因组的病毒
[编辑]有些病毒含有整套以RNA形式编码的基因组,因此他们只有RNA→蛋白质的编译形式。
拟逆转录(病毒DNA整合到宿主DNA)
[编辑]近年在植物体内发现了拟逆转录病毒(pararetrovirus),这种病毒的遗传物质是双链DNA,能像逆转录病毒一样,通过把自己的DNA整合到寄主的基因组DNA中去,再进行复制[3]。
遗传信息的特殊传递
[编辑]逆转录
[编辑]
在中心法则被详细阐述之后,人们发现了逆转录病毒[4],例如,人类免疫缺陷病毒(HIV)和在真核生物中反转录转座子和端粒的合成。这些病毒可通过一种叫做逆转录酶的催化,以RNA为模板逆转录合成cDNA再由cDNA转录出RNA。这肯定了RNA向DNA转录的存在。人们最初以为这种现象仅出现于病毒中,但在最近,在高等动物中亦发现了RNA向DNA转录的逆转录转座子。
RNA复制
[编辑]有些病毒的遗传物质是RNA分子,靠RNA复制而传代,以RNA为模板的RNA复制酶催化下合成RNA分子,RNA复制酶中缺乏校正功能,复制时错误率很高。RNA复制酶只对病毒本身的RNA起作用,而不会作用于宿主细胞中的RNA分子[5]。
RNA编辑,在其中的RNA序列是由蛋白质的复合体和一个“引导RNA”改变,也可以看作是一种RNA到RNA的转移。
RNA的催化功能
[编辑]人们一直认为生物体内的各种生化反应都是由酶来催化完成的,而RNA仅是存贮与传递信息,与酶的催化反应无关。核糖核酸酶P是一种核酶,即由一个RNA分子发挥催化活性,它是第一个被发现的蛋白质以外具有催化活性的生物大分子。它的功能是剪切tRNA分子中RNA上多余的或前体的多余序列[6]。RNA可以不通过蛋白质而直接表现出本身的某些遗传信息,而这种信息并不是以核苷酸三联密码来编码。
直接以DNA为模板合成蛋白质
[编辑]有人在一些离体实验中观察到,一些与蛋白质合成抑制剂类抗生素如新霉素和链霉素,能扰乱核糖体对信使的选择,从而可以接受单链DNA分子代替mRNA,然后以单链DNA为模版,按核苷酸顺序转译成多肽的氨基酸顺序[7]。另外还有研究表明,细胞核里的DNA可以直接转移到细胞质中的核糖体上,不需要通过RNA也可以控制蛋白质的合成[8]。
DNA也具有酶活性
[编辑]1994年乔依斯等人发现一个人工合成的DNA分子具有一种特殊的磷酸二酯酶活性。此后又有多例报道人工合成的DNA序列具有各种不同的酶活性。1995年中国学者王身立等人发现从多种生物中提取的DNA均具有酯酶活性,能催化乙酸萘酯水解为萘酚和乙酸。这种较弱的酯酶活性是非特异性DNA的一般性质,并不需要特测序列的DNA编码。
中心法则的扩充
[编辑]克里克在上述那篇1970年的文章中指出,中心法则虽然对指导实验很有用,但不应该被当成教条:
| “ | 虽然本文所提出的各类法则看来是可靠的,可是我们对分子生物学的认识,即使只是一个细胞—更不用说大自然里的整个生命体—仍然远远未完备到,足以让我们把它当成教条一样肯定正确的程度 | ” |
| ——克里克[9] | ||
自从克里克发表1970年那篇文章以来,很多新发现说明了中心法则补充和发展的必要。
转译后修饰
[编辑]对于大部分的蛋白质来说,这是蛋白质生物合成的最后步骤。蛋白质的翻译后修饰会附上其他的生物化学官能团、改变氨基酸的化学性质,或是造成结构的改变来扩阔蛋白质的功能。酶可以从蛋白质的N末端移除氨基酸,或从中间将肽链剪开。举例来说,胰岛素是肽的激素,它会在建立双硫键后被剪开两次,并在链的中间移走多肽前体,而形成的蛋白质包含了两条以双硫键连接的多肽链。其他修饰,就像磷酸化,是控制蛋白质活动机制的一部分。蛋白质活动可以是令酶活性化或钝化。
蛋白质的内含子
[编辑]蛋白质有自剪接现象,与mRNA相同,一些蛋白质前体具有内含子(intein)序列,多肽序列中间的某些区域被加工切除,剩余部分的蛋白质外显子(extein)重新连接为蛋白质分子[10]。
DNA甲基化
[编辑]表观遗传学研究在没有细胞核DNA序列改变的情况时,基因功能的可逆的、可遗传的改变。这些改变包括DNA的修饰(如甲基化修饰)、RNA干扰、组蛋白的各种修饰等。也指生物发育过程中包含的程序的研究。在这两种情况下,研究的对象都包括在DNA序列中未包含的基因调控信息如何传递到(细胞或生物体的)下一代这个问题。其主要研究内容包括大致两方面内容。一类为基因选择性转录表达的调控,有DNA甲基化,基因印记,组蛋白共价修饰,染色质重塑。另一类为基因转录后的调控,包含基因组中非编码的RNA,微小RNA,反义RNA,内含子及核糖开关等。
DNA甲基化为DNA化学修饰的一种形式,能在不改变DNA序列的前提下,改变遗传表现。为外遗传编码(epigenetic code)的一部分,是一种外遗传机制。DNA甲基化过程会使甲基添加到DNA分子上,例如在胞嘧啶环的5'碳上:这种5'方向的DNA甲基化方式可见于所有脊椎动物[11][12]。
非核糖体多肽合成酶
[编辑]非核糖体肽合成酶(non-ribosomal peptide synthetase,NRPS)在细菌和真菌中,不经过核糖体、利用标准氨基酸和非蛋白氨基酸及其他一些不是氨基酸的化合物(如水杨酸、吡啶羧酸等)、不以信使核糖核酸(mRNA)为模板,也不需要转移核糖核酸(tRNA)为携带工具的特殊的多肽合成系统中起关键作用的一类特殊的酶。通常由一系列组件顺序排列组成,每个组件负责一个反应循环,包括对选择性底物的识别并将其激活成相应的腺苷酸化合物、共价中间物的固定和肽键的形成。这种顺序排列的组件即构成了该酶所合成多肽的一种模板。这些肽可以是线状或环状的,并且经常已经被广泛地化学修饰。
蛋白质可作为合成DNA的模板
[编辑]来自美国Mount.Sinai医院的研究人员发现了一种叫Rev1 DNA聚合酶的蛋白质,它可以为DNA复制提供编码信息。许多致癌物质会倾向于破坏DNA的鸟嘌呤(G),或者是破坏鸟嘌呤与胞嘧啶(C)的配对,这些都会导致DNA错配的发生。新发现的蛋白质可以以自身为模板在复制链上加一个胞嘧啶,这个胞嘧啶无论鸟嘌呤是否在DNA链中存在都会被Rev1加上去的,在DNA复制时可以利用一条单链,根据碱基配对原则复制出新的DNA链。细胞利用这种崭新的机制在含有致癌物质的情况下对受损的DNA进行复制。这是第一次发现蛋白质可以作为一种合成DNA的模板[13]。
朊毒体
[编辑]朊毒体是通过改变其他蛋白质的构象来进行自身精确复制的一类蛋白质。也就是:蛋白质→蛋白质。这种具有感染性的因子主要由蛋白质组成。具有感染性的因子PrpSC与正常因子PrPC在形状上有一点不同。科学家推测这种变形的蛋白质会引起正常的PrPC转变成具有感染性的蛋白质,这种链式反应使得正常的蛋白质和致病的蛋白质因子都成为新毒朊。
对中心法则作为研究策略的批评
[编辑]一些系统生物学家认为中心法则有时会被滥用作一种研究策略。他们认为,不加批判地死板套用中心法则,会加大认识多细胞发育和疾病的难度。中心法则会常被当作是一种简化论研究策略,从小处着眼,企求用分子生物学去解释一切生物现象。虽然这些研究人员不会执拗于中心法则的具体解读,但他们会认为这种简化论研究策略会阻碍人们去理解一些无法单独靠分子相互作用解释的复杂系统[14]。
参见
[编辑]参考文献
[编辑]- ^ Crick, F.H.C. (1958): On Protein Synthesis. (页面存档备份,存于互联网档案馆) Symp. Soc. Exp. Biol. XII, 139-163. (pdf, early draft of original article)
- ^ Crick, F. Central dogma of molecular biology. (PDF). Nature. August 1970, 227 (5258): 561–3 [2012-11-23]. Bibcode:1970Natur.227..561C. PMID 4913914. doi:10.1038/227561a0. (原始内容存档 (PDF)于2020-01-26).
- ^ Temin HM. Reverse transcription in the eukaryotic genome: retroviruses, pararetroviruses, retrotransposons, and retrotranscripts. Mol. Biol. Evol. November 1985, 2 (6): 455–68 [2012-11-23]. PMID 2835576. (原始内容存档于2019-09-24).
- ^ HOWARD M. TEMIN, SATOSHI MIZUTANI. Viral RNA-dependent DNA Polymerase: RNA-dependent DNA Polymerase in Virions of Rous Sarcoma Virus. Nature. 1970-06, 226 (5252): 1211–1213 [2018-04-02]. ISSN 1476-4687. doi:10.1038/2261211a0 (英语).
- ^ Ahlquist P. RNA-dependent RNA polymerases, viruses, and RNA silencing. Science. May 2002, 296 (5571): 1270–3. Bibcode:2002Sci...296.1270A. PMID 12016304. doi:10.1126/science.1069132.
- ^ (英文)Guerrier-Takada C, Gardiner K, Marsh T, Pace N, Altman S. The RNA moiety of ribonuclease P is the catalytic subunit of the enzyme. Cell. 1983, 35 (3 Pt 2): 849–57. PMID 6197186.
- ^ B. J. McCarthy and J. J. Holland. Denatured DNA as a Direct Template for in vitro Protein Synthesis. Proceedings of the National Academy of Sciences of the United States. September 15, 1965, 54 (3): 880–886. Bibcode:1965PNAS...54..880M. PMC 219759
 . PMID 4955657. doi:10.1073/pnas.54.3.880.
. PMID 4955657. doi:10.1073/pnas.54.3.880.
- ^ .T. Uzawa, A. Yamagishi, T. Oshima. Polypeptide Synthesis Directed by DNA as a Messenger in Cell-Free Polypeptide Synthesis by Extreme Thermophiles, Thermus thermophilus HB27 and Sulfolobus tokodaii Strain 7. The Journal of Biochemistry. 2002-04-09, 131 (6): 849–853. PMID 12038981.
- ^ 原文:“Although the details of the classification proposed here are plausible, our knowledge of molecular biology, even in one cell -- let alone for all the organisms in nature -- is still far too incomplete to allow us to assert dogmatically that it is correct.”
- ^ Anraku Y, Mizutani R, Satow Y. Protein splicing: its discovery and structural insight into novel chemical mechanisms. IUBMB Life. 2005, 57 (8): 563–74. PMID 16118114. doi:10.1080/15216540500215499.
- ^ Dodge, Jonathan E.; Bernard H. Ramsahoyeb; Z. Galen Woa; Masaki Okanoa, En Li. De novo methylation of MMLV provirus in embryonic stem cells: CpG versus non-CpG methylation. Science Direct. May 2002 [2012-11-23]. (原始内容存档于2019-02-15).
- ^ Haines, Thomas R.; Rodenhiser, David I.; Ainsworth, Peter J. Allele-Specific Non-CpG Methylation of the Nf1 Gene during Early Mouse Development. Science Direct. Dec 2001 [2012-11-23]. (原始内容存档于2019-02-15).
- ^ Nair DT, Johnson RE, Prakash L, Prakash S, Aggarwal AK. Rev1 employs a novel mechanism of DNA synthesis using a protein template.. Science. 2005 Sep 30;309(5744): 2219–22.
- ^ Werner,2005
- 1958 Crick, F.H.C., On Protein Synthesis.(页面存档备份,存于互联网档案馆) in Symp. Soc. Exp. Biol. XII, 139-163.(pdf, early draft of original article)
- 1970 Crick, F., Central Dogma of Molecular Biology. Nature 227, 561-563.
- 2005 Werner, E., Genome Semantics, In Silico Multicellular Systems and the Central Dogma, FEBS Letters 579, pp 1779-1782 (March 21, 2005).
外部链接
[编辑]- (英文)中心法则:Article from Knowmed Article Repository: A history of the development of the dogma, listing a few key experiments
- (英文)Animation: The Central Dogma(页面存档备份,存于互联网档案馆) - Nature video
- (英文)The Elaboration of the Central Dogma(页面存档备份,存于互联网档案馆) - Scitable: By Nature Education
- (英文)Discussion on challenges to the "Central Dogma of Molecular Biology"(页面存档备份,存于互联网档案馆)
- (英文)Explanation of the central dogma using a musical analogy(页面存档备份,存于互联网档案馆)
- (英文)"Francis Harry Compton Crick (1916-2004)" by A. Andrei at the Embryo Project Encyclopedia(页面存档备份,存于互联网档案馆)
- (英文)Central dogma as a case of knowledge shielding(页面存档备份,存于互联网档案馆)
