甲基锂
外观
此条目需要扩充。 (2011年4月25日) |
此条目需要精通或熟悉相关主题的编者参与及协助编辑。 (2010年11月13日) |
| 甲基锂 | |
|---|---|
| |
| IUPAC名 Methyllithium | |
| 别名 | Lithium methanide |
| 识别 | |
| CAS号 | 917-54-4 |
| PubChem | 2724049 451241((11C)) 11115973((13C)) 10887814((14C)) 11105293((2H3)) |
| ChemSpider | 10254338 |
| SMILES |
|
| InChI |
|
| InChIKey | DVSDBMFJEQPWNO-UHFFFAOYSA-N |
| Beilstein | 3587162 |
| Gmelin | 288 |
| EINECS | 213-026-4 |
| ChEBI | 51486 |
| 性质 | |
| 化学式 | CH3Li |
| 摩尔质量 | 21.98 g·mol⁻¹ |
| 溶解性(水) | 剧烈反应 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
甲基锂是一个有机锂试剂,化学式为CH3Li。这种s区的有机金属化合物无论在固体或溶液中都是低聚态。这种高活性的化合物经常用于合成醚,并用于有机合成和有机金属化学。涉及到它的反应需要在无水条件下进行,因为它与水剧烈反应。氧气和二氧化碳也不能与它共存。因此甲基锂使用前通常不事先制备,但可以溶解在各种醚溶液中储存。
制备
[编辑]- 2 Li + MeBr → LiMe + LiBr
该反应的产物是复杂的,大多数商用的甲基锂由此法制备。不含卤化物的甲基锂可以从氯甲烷制备。[1] 氯化锂在乙醚中很容易沉淀,因此不会混杂在甲基锂中。通过过滤可以获得比较纯净的甲基锂。
反应
[编辑]结构
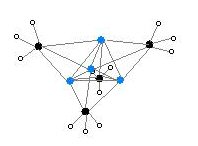
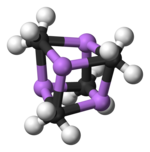
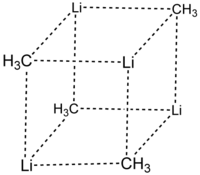
[编辑]单晶X射线晶体学发现它具有两种结构,6Li、7Li和13C核磁共振也说明了这一点。这个四聚的原子簇形状是扭曲的立方烷,碳原子和锂原子取代了顶角。Li-Li键的键长是 2.68 Å, 几乎和气态双锂中的Li-Li键一样长。C-Li键的键长是2.31 Å。一个碳原子与三个氢原子和三个锂原子形成化学键。(MeLi)4的难挥发性和它在烷烃中不溶解的结构表明原子簇的相互作用和原子簇间的抓氢键。与此相反的大位阻物质叔丁基锂的原子簇间的相互作用被空间位阻效应削弱,它是不稳定的,并且可以溶于烷烃。[2]
颜色: Li-蓝 C-黑 H-白
成键
[编辑]参考资料
[编辑]- ^ Lusch, M. J.; Phillips, M. V.; Sieloff, W. V.; Nomura, G. S.; House, H. O. (1990). "Preparation of Low-Halide Methyllithium". Org. Synth.; Coll. Vol. 7: 346.
- ^ Elschenbroich, C. ”Organometallics” (2006) Wiley-VCH: Weinheim. ISBN 978-3-29390-6