Fc受體
| 免疫球蛋白樣受體 | |
|---|---|
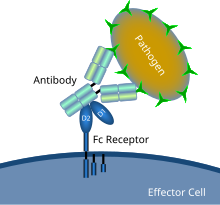 示意圖顯示了Fc受體與抗體包被的微生物病原體的相互作用 | |
| 鑑定 | |
| 標誌 | Fc受體 |
| 膜蛋白資料庫 | 10 |
Fc受體(英文:Fc Receptor)是在某些細胞表面發現的蛋白質,其中包括B淋巴球、濾泡樹突細胞、自然殺傷細胞、巨噬細胞、中性粒細胞、嗜酸性粒細胞、嗜鹼性粒細胞、人類血小板和肥大細胞——它們都有助於免疫系統的保護功能。它的名字來源於它對被稱為Fc(可結晶片段區域)的抗體的一部分的結合特異性。Fc受體與附著在受感染細胞或入侵的病原體上的抗體結合。它們的活性通過抗體介導的吞噬作用或抗體依賴的細胞介導的細胞毒性刺激吞噬細胞或細胞毒性細胞破壞微生物或感染細胞。一些病毒(如黃病毒)使用Fc受體來幫助它們感染細胞,這種機制被稱為抗體依賴性增強感染。[1]
分類
[編輯]有幾種不同類型的Fc受體,它們根據它們識別的抗體類型進行分類。與最常見的一類抗體IgG結合的稱為Fcγ受體,與IgA結合的稱為Fcα受體,與IgE結合的稱為Fcε受體。Fc受體的類別還通過表達它們的細胞(巨噬細胞、粒細胞、自然殺傷細胞、T細胞和B細胞)和每個受體的信號傳導特性來區分。[2]
Fcγ受體
[編輯]所有的Fcγ受體都屬於免疫球蛋白超家族,是調理素(標記)微生物吞噬作用最重要的Fc受體。[3]該家族包括幾個成員,Fcγ受體I(CD64)、Fcγ受體IIA(CD32)、Fcγ受體IIB(CD32)、Fcγ受體IIIA(CD16a)、Fcγ受體IIIB(CD16b),由於其不同的分子結構,它們的抗體親和力不同。[4]例如,Fcγ受體I與IgG的結合比Fcγ受體II或Fcγ受體III更強。Fcγ受體I還具有由三個免疫球蛋白樣結構域組成的細胞外部分,比Fcγ受體II或Fcγ受體III多一個結構域。這種特性允許Fcγ受體I結合單個IgG分子(或單體),但所有Fcγ受體必須結合免疫複合物中的多個IgG分子才能被激活。[5]
不同的Fcγ受體對IgG的親和力各不相同,同樣的,不同的IgG亞類對每種Fcγ受體都有獨特的親和力。這些相互作用由IgG CH2-84.4位置的聚糖(寡糖)進一步調節。 例如,通過產生位阻,含有CH2-84.4聚糖的岩藻糖會降低IgG對Fcγ受體IIIA的親和力。相反,缺乏半乳糖並以GlcNAc部分終止的G0聚糖對Fcγ受體IIIA的親和力會增加。
另一種Fc受體在多種細胞類型上表達,在結構上與MHC I類分子相似。該受體也結合IgG並參與該抗體的保存。[6]然而,由於這種Fc受體還參與將IgG從母親通過胎盤轉移到胎兒或通過乳汁轉移到哺乳期嬰兒,因此它被稱為新生兒Fc受體(FcRn)。[7][8]最近,研究表明該受體在IgG血清水平的穩態中發揮作用。
Fcα受體
[編輯]只有一種Fc受體屬於Fcα受體亞組,稱為Fcα受體I(CD89)。[9]Fcα受體I存在於中性粒細胞、嗜酸性粒細胞、單核細胞、一些巨噬細胞(包括庫普弗細胞)和一些樹突狀細胞的表面。[9]它由兩個細胞外Ig樣結構域組成,是免疫球蛋白超家族和多鏈免疫識別受體(MIRR)家族的成員。[3]它通過與兩條Fc受體γ信號鏈結合發出信號。[9]另一種受體也可以結合IgA,儘管它對另一種稱為IgM的抗體具有更高的親和力。[10]這種受體稱為Fcα/μ受體(Fcα/μR),是一種I型跨膜蛋白。這種Fc受體在其細胞外部分有一個Ig樣結構域,它也是免疫球蛋白超家族的一員。[11]
Fcε受體
[編輯]已知有兩種類型的Fcε受體:[3]
- 高親和力受體Fcε受體I是免疫球蛋白超家族的成員(它有兩個 Ig 樣結構域)。Fcε受體I存在於表皮朗格漢斯細胞、嗜酸性粒細胞、肥大細胞和嗜鹼性粒細胞中。[12][13]由於其細胞分布,該受體在控制過敏反應中起主要作用。Fcε受體I也在抗原呈遞細胞上表達,並控制促炎性細胞因子的重要免疫介質的產生。[14]
- 低親和力受體Fcε受體II(CD23)是一種C-型凝集素。Fcε受體II作為膜結合或可溶性受體具備多種功能:它能控制B細胞的生長和分化,並阻斷嗜酸性粒細胞、單核細胞和嗜鹼性粒細胞的IgE結合。[15]
匯總表
[編輯]| 受體名稱 | 主要抗體配體 | 對配體的親和力 | 細胞分布 | 與抗體結合後的效果 |
| Fcγ受體I(CD64) | IgG1和IgG3 | 高(Kd~10−9M) | 巨噬細胞中性粒細胞嗜酸性粒細胞樹突狀細胞 | 吞噬作用
細胞活化 激活呼吸爆發 誘導殺滅微生物 |
| Fcγ受體IIA(CD32) | IgG | 低(Kd>10−7M) | 巨噬細胞 | 吞噬作用
脫顆粒(嗜酸性粒細胞) |
| Fcγ受體IIB1(CD32) | IgG | 低(Kd>10−7M) | B細胞肥大細胞 | 無吞噬作用
抑制細胞活性 |
| Fcγ受體IIB2(CD32) | IgG | 低(Kd>10−7M) | 巨噬細胞
中性粒細胞 嗜酸性粒細胞 |
吞噬作用
抑制細胞活性 |
| Fcγ受體IIIA(CD16) | IgG | 低(Kd>10−6M) | 自然殺傷細胞巨噬細胞(某些組織) | 誘導抗體依賴的細胞介導的細胞毒性作用(ADCC)
巨噬細胞誘導細胞因子釋放 |
| Fcγ受體IIIB(CD16) | IgG | 低(Kd>10−6M) | 嗜酸性粒細胞
巨噬細胞 中性粒細胞 肥大細胞 濾泡樹突細胞 |
誘導殺滅微生物 |
| Fcε受體I | IgE | 高(Kd~10−10M) | 肥大細胞
嗜酸性粒細胞 嗜鹼性粒細胞 朗格漢斯細胞 單核細胞 |
脫顆粒
吞噬作用 |
| Fcε受體II(CD23) | IgE | 低(Kd>10−7M) | B細胞
嗜酸性粒細胞 朗格漢斯細胞 |
有可能的粘附分子
IgE跨腸上皮細胞轉運 增強過敏性致敏的正反饋機制(B細胞) |
| Fcα受體I(CD89) | IgA | 低(Kd>10−6M) | 單核細胞
巨噬細胞 中性粒細胞 嗜酸性粒細胞 |
吞噬作用
誘導殺滅微生物 |
| Fcα/μ受體(CD351) | IgA和IgM | IgM為高,IgA為中等 | B細胞
繫膜細胞 巨噬細胞 |
胞吞作用誘導殺滅微生物 |
| Fcμ受體[16] | IgM | 未知 | 人類Fcμ受體主要由淋巴細胞表達,但不由吞噬細胞表達[17] | 功能尚未完全闡明/多樣化[18] |
| 新生兒Fc受體 | IgG | 在酸性細胞內體,高
在pH中性細胞外環境,低 |
單核細胞 | 通過胎盤將IgG從母親轉移到胎兒
通過乳汁將IgG從母親轉移到嬰兒 保護IgG免於降解 跨內皮/上皮層轉移IgG |
作用
[編輯]
Fc受體存在於免疫系統的許多細胞上,包括巨噬細胞和單核細胞等吞噬細胞、中性粒細胞和嗜酸性粒細胞等粒細胞,以及先天免疫系統(自然殺傷細胞)或適應性免疫系統(B細胞)的淋巴細胞。[19][20][21]它們允許這些細胞與附著在微生物或微生物感染細胞表面的抗體結合,並幫助這些細胞識別和消除微生物病原體。Fc受體在其Fc區(或尾部)結合抗體,這種相互作用可激活擁有Fc受體的細胞。[22]
激活吞噬細胞是Fc受體最常見的功能。例如,巨噬細胞在與Fcγ受體結合後開始通過吞噬作用攝取並殺死IgG包被的病原體。[23]另一個涉及Fc受體的過程稱為抗體依賴的細胞介導的細胞毒性作用(ADCC)。在ADCC期間,自然殺傷細胞表面的Fcγ受體III刺激自然殺傷細胞從其顆粒體中釋放細胞毒性分子以殺死抗體覆蓋的細胞。[24]
Fcε受體I具有不一樣的功能。Fcε受體I是粒細胞上的Fc受體,參與過敏反應和抵禦寄生蟲感染。當存在合適的過敏抗原或寄生蟲時,至少兩個IgE分子及其Fc受體在粒細胞表面的交聯將觸發細胞從其顆粒體中快速釋放預先形成的介質。[3]
信號機制 - Fcγ受體
[編輯]激活
[編輯]Fcγ受體屬於免疫受體,它們共享相似的信號通路(涉及酪氨酸殘基磷酸化)。[25]這些受體通過稱為免疫受體酪氨酸活化基序(ITAM)的重要激活基序在其細胞內產生信號。[26]ITAM是一種特定的胺基酸序列(YXXL),在受體的細胞內尾部連續出現兩次。當磷酸鹽基團通過Src家族激酶的膜錨定酶添加到ITAM的酪氨酸(Y)殘基時,細胞內會產生信號級聯。這種磷酸化反應通常發生在Fc受體與其配體相互作用之後。ITAM存在於Fcγ受體IIA的細胞內尾部,其磷酸化會誘導巨噬細胞的吞噬作用。Fcγ受體I和Fcγ受體IIIA沒有ITAM,但可以通過與另一種具有ITAM的蛋白質相互作用將並激活信號傳遞給它們的吞噬細胞。這種銜接蛋白稱為Fcγ亞基,與Fcγ受體IIA一樣,包含ITAM特有的兩個YXXL序列。
抑制
[編輯]僅存在一個YXXL基序不足以激活細胞,它代表一種基序(I/VXXYXXL),稱為基於免疫受體酪氨酸的抑制基序(ITIM)。Fcγ受體IIB1和Fcγ受體IIB2具有ITIM序列,是抑制性Fc受體(它們不誘導吞噬作用)。這些受體的抑制作用受從酪氨酸殘基上去除磷酸基團的酶控制,磷酸酶PTPN6和INPP5D抑制Fcγ受體的信號傳導。[27]配體與Fcγ受體IIB的結合導致ITAM基序的酪氨酸磷酸化。這種修飾產生了磷酸酶的結合位點,一個SH2識別域。ITAM激活信號的取消是由Src家族蛋白酪氨酸激酶的抑制引起的,並且通過水解膜PIP3中斷激活受體的進一步下游信號,例如激活Fcγ受體s、TCR、BCR 和細胞因子受體(例如c-Kit).[28]
Fcγ受體IIB的負信號傳導對於活化B細胞的調節非常重要。陽性B細胞信號傳導是由外來抗原與表面免疫球蛋白的結合啟動的。分泌相同的抗原特異性抗體,它可以反饋抑制或促進負信號傳導。這種負向信號由Fcγ受體IIB提供。[29]使用B細胞缺失突變體和顯性失活酶的實驗已經證明了含有SH2結構域的肌醇5-磷酸酶(SHIP)在負信號傳導中的重要作用。通過SHIP的負信號似乎通過SH2結構域與Grb2和Shc的競爭抑制Ras通路,並且可能涉及細胞內脂質介質的消耗,這些介質充當變構酶激活劑或促進細胞外Ca2+的進入。[30]
細胞激活
[編輯]
吞噬細胞
[編輯]當對某種抗原或表面成分具有特異性的IgG分子通過其Fab(抗原結合片段區)與病原體結合時,其Fc區指向外,可直接到達吞噬細胞。吞噬細胞將這些Fc區與其Fc受體結合。[23]許多低親和力的相互作用在受體和抗體之間形成,它們共同作用以緊密結合抗體包被的微生物。低個體親和力阻止Fc受體在沒有抗原的情況下結合抗體,因此減少了在沒有感染的情況下免疫細胞激活的機會。當沒有抗原時,這也可以防止抗體對吞噬細胞的凝集。結合病原體後,抗體的Fc區與吞噬細胞的Fc受體之間的相互作用導致吞噬作用的啟動。病原體通過涉及結合和釋放Fc區或Fc受體複合物的活躍過程被吞噬細胞吞沒,直到吞噬細胞的細胞膜完全包圍病原體。[31]
自然殺傷細胞
[編輯]自然殺傷細胞上的Fc受體識別與病原體感染的靶細胞表面的IgG結合,稱為CD16或Fcγ受體III。[32]IgG對Fcγ受體III的激活導致細胞因子(如II型干擾素)的釋放,這些細胞因子向其他免疫細胞發出信號,而釋放出的細胞毒性介質(如穿孔素和顆粒酶)會進入靶細胞並通過觸發細胞凋亡促進細胞死亡。自然殺傷細胞上的Fcγ受體III也可以與單體IgG(即未與抗原結合的IgG)結合。發生這種情況時,Fc受體會抑制自然殺傷細胞的活性。[33]
肥大細胞
[編輯]
IgE抗體與過敏原的抗原結合。這些過敏原結合的IgE分子與肥大細胞表面的Fcε受體進行相互作用。與Fcε受體I結合後,肥大細胞的激活會導致脫顆粒,肥大細胞由此從其細胞質顆粒中釋放預製分子(包括組胺、蛋白聚糖和絲氨酸蛋白酶在內的化合物的混合物)。[34]活化的肥大細胞還會合成和分泌脂質衍生介質(如前列腺素、白三烯和血小板活化因子)和細胞因子(如白血球介素-1、白血球介素-3、白血球介素-4、白血球介素-5、白血球介素-6、白血球介素-13、腫瘤壞死因子、GM-CSF和幾種趨化因子。)[35][36]這些介質通過吸引其他白血球而導致炎症。
嗜酸性粒細胞
[編輯]曼氏血吸蟲等大型寄生蟲體型太大,無法被吞噬細胞吞噬。它們還有一個稱為珠被的外部結構,可以抵抗巨噬細胞和肥大細胞釋放的物質的攻擊。然而,這些寄生蟲可以被IgE包裹並被嗜酸性粒細胞表面的Fcε受體II識別。活化的嗜酸性粒細胞釋放預先形成的介質,如主要鹼性蛋白和酶(過氧化物酶),蠕蟲對其不具有抗性。[37][38]Fcε受體II與蠕蟲結合IgE的Fc部分的相互作用會導致嗜酸性粒細胞以類似於ADCC期間自然殺傷細胞的機制釋放這些分子。[39]
T淋巴細胞
[編輯]CD4+ T細胞(輔助性T細胞)為產生抗體的B細胞提供幫助。在疾病病理學中觀察到幾個激活的效應CD4+ T細胞亞群。Sanders和Lynch在1993年總結的早期研究表明,Fc受體在CD4+ T細胞介導的免疫反應中起著關鍵作用,並提出在細胞表面的Fc受體和T細胞受體之間形成聯合信號複合物。[40][41][42][43]Chauhan及其同事報告了標記的免疫複合物(IC)與活化的CD4+ T細胞表面上的CD3複合物共定位,因此表明Fc受體與T細胞受體複合物共存。[44]觀察到這兩種受體在活化的CD4+ T細胞膜上形成頂端結構,這表明這些受體的橫向運動。[44]在細胞表面觀察到Fc受體與T細胞受體和B細胞受體複合物的共遷移,T/B細胞偶聯物在接觸點顯示這種共存。[45]較早的報告表明Fc受體在CD4+ T細胞上的表達是一個懸而未決的問題。[46]這確立了T細胞不表達Fc受體的當前範例,並且這些發現從未受到挑戰和實驗測試。[47]Chauhan及其同事展示IC與激活的CD4+ T細胞的Fc受體配體結合。[47]CD16a表達在活化的人類未成熟CD4+ T細胞中被誘導,這些細胞表達CD25、CD69和CD98,並且與IC的連接導致效應記憶細胞的產生。[48]CD16a信號由Syk(pSyk)的磷酸化介導。[48][49][50]
現在的一項研究表明,激活人類CD4+ T細胞後會誘導CD32a的表達,類似於CD16a。[51][52]HIV-1研究人員的三項獨立研究也表明了CD4+ T細胞上的CD32a表達。CD16a和CD32a在活化的CD4+ T細胞亞群中的表達現已得到證實。[51][52]細胞表面的Fc受體在與由核酸組成的IC結合後觸發細胞因子的產生並上調核酸傳感途徑。Fc受體存在於細胞表面和胞質溶膠中。CD16a信號上調核酸感應Toll樣受體的表達,並將它們重新定位到細胞表面。[53][54]CD16a是人類CD4+ T細胞的一種新的共刺激信號,它成功地替代了自身免疫過程中的CD28需求。[55]在自身免疫背景下,CD4+ T細胞繞過CD28協同信號轉導的要求而完全激活。[55]此外,CD28協同信號傳導的阻斷不會抑制TFH細胞的發育,TFH細胞是產生自身抗體的自身反應性漿B細胞的關鍵亞群。[56]免疫穩態需要共刺激信號和抑制信號之間的平衡。過度的共刺激或不充分的共抑制會導致耐受性崩潰和自身免疫。CD16a介導的共刺激在活化的CD4+ T細胞中提供陽性信號,而不是在缺乏Fcγ受體表達的靜止細胞中。[51]
參見
[編輯]參考文獻
[編輯]- ^ Anderson R. Manipulation of cell surface macromolecules by flaviviruses. Advances in Virus Research. 2003, 59: 229–74. ISBN 9780120398591. PMC 7252169
 . PMID 14696331. doi:10.1016/S0065-3527(03)59007-8.
. PMID 14696331. doi:10.1016/S0065-3527(03)59007-8.
- ^ Owen J, Punt J, Stranford S, Jones P. Immunology 7th. New York: W.H. Freeman and Company. 2009: 423. ISBN 978-14641-3784-6.
- ^ 3.0 3.1 3.2 3.3 Fridman WH. Fc receptors and immunoglobulin binding factors. FASEB Journal. September 1991, 5 (12): 2684–90. PMID 1916092. S2CID 16805557. doi:10.1096/fasebj.5.12.1916092.
- ^ Indik ZK, Park JG, Hunter S, Schreiber AD. The molecular dissection of Fc gamma receptor mediated phagocytosis. Blood. December 1995, 86 (12): 4389–99. PMID 8541526. doi:10.1182/blood.V86.12.4389.bloodjournal86124389
 .
.
- ^ Harrison PT, Davis W, Norman JC, Hockaday AR, Allen JM. Binding of monomeric immunoglobulin G triggers Fc gamma RI-mediated endocytosis. The Journal of Biological Chemistry. September 1994, 269 (39): 24396–402. PMID 7929100. doi:10.1016/S0021-9258(19)51097-3
 .
.
- ^ Zhu X, Meng G, Dickinson BL, Li X, Mizoguchi E, Miao L, Wang Y, Robert C, Wu B, Smith PD, Lencer WI, Blumberg RS. MHC class I-related neonatal Fc receptor for IgG is functionally expressed in monocytes, intestinal macrophages, and dendritic cells. Journal of Immunology. March 2001, 166 (5): 3266–76. PMC 2827247
 . PMID 11207281. doi:10.4049/jimmunol.166.5.3266.
. PMID 11207281. doi:10.4049/jimmunol.166.5.3266.
- ^ Firan M, Bawdon R, Radu C, Ober RJ, Eaken D, Antohe F, Ghetie V, Ward ES. The MHC class I-related receptor, FcRn, plays an essential role in the maternofetal transfer of gamma-globulin in humans. International Immunology. August 2001, 13 (8): 993–1002. PMID 11470769. doi:10.1093/intimm/13.8.993
 .
.
- ^ Simister NE, Jacobowitz Israel E, Ahouse JC, Story CM. New functions of the MHC class I-related Fc receptor, FcRn. Biochemical Society Transactions. May 1997, 25 (2): 481–6. PMID 9191140. doi:10.1042/bst0250481.
- ^ 9.0 9.1 9.2 Otten MA, van Egmond M. The Fc receptor for IgA (FcalphaRI, CD89). Immunology Letters. March 2004, 92 (1–2): 23–31. PMID 15081523. doi:10.1016/j.imlet.2003.11.018.
- ^ Shibuya A, Honda S. Molecular and functional characteristics of the Fcalpha/muR, a novel Fc receptor for IgM and IgA. Springer Seminars in Immunopathology. December 2006, 28 (4): 377–82. PMID 17061088. S2CID 23794895. doi:10.1007/s00281-006-0050-3.
- ^ Cho Y, Usui K, Honda S, Tahara-Hanaoka S, Shibuya K, Shibuya A. Molecular characteristics of IgA and IgM Fc binding to the Fcalpha/muR. Biochemical and Biophysical Research Communications. June 2006, 345 (1): 474–8 [2022-11-30]. PMID 16681999. doi:10.1016/j.bbrc.2006.04.084. hdl:2241/102010
 . (原始內容存檔於2018-11-03).
. (原始內容存檔於2018-11-03).
- ^ Ochiai K, Wang B, Rieger A, Kilgus O, Maurer D, Födinger D, Kinet JP, Stingl G, Tomioka H. A review on Fc epsilon RI on human epidermal Langerhans cells. International Archives of Allergy and Immunology. 1994,. 104 Suppl 1 (1): 63–4. PMID 8156009. doi:10.1159/000236756.
- ^ Prussin C, Metcalfe DD. 5. IgE, mast cells, basophils, and eosinophils. The Journal of Allergy and Clinical Immunology. February 2006, 117 (2 Suppl Mini–Primer): S450–6. PMID 16455345. doi:10.1016/j.jaci.2005.11.016.
- ^ von Bubnoff D, Novak N, Kraft S, Bieber T. The central role of FcepsilonRI in allergy. Clinical and Experimental Dermatology. March 2003, 28 (2): 184–7. PMID 12653710. S2CID 2080598. doi:10.1046/j.1365-2230.2003.01209.x.
- ^ Kikutani H, Yokota A, Uchibayashi N, Yukawa K, Tanaka T, Sugiyama K, Barsumian EL, Suemura M, Kishimoto T. Structure and function of Fc epsilon receptor II (Fc epsilon RII/CD23): a point of contact between the effector phase of allergy and B cell differentiation. Ciba Foundation Symposium. Novartis Foundation Symposia. 1989, 147: 23–31; discussion 31–5. ISBN 9780470513866. PMID 2695308. doi:10.1002/9780470513866.ch3.
- ^ FCMR Fc mu receptor [Homo sapiens (Human)] - Gene - NCBI. [2022-12-02]. (原始內容存檔於2018-12-16).
- ^ Kubagawa H, Oka S, Kubagawa Y, Torii I, Takayama E, Kang DW, et al. Identity of the elusive IgMFc receptor (FcmuR) in humans. J. Exp. Med. 2009, 206 (12): 2779–93. PMC 2806608
 . PMID 19858324. doi:10.1084/jem.20091107.
. PMID 19858324. doi:10.1084/jem.20091107.
- ^ Liu J, Wang Y, Xiong E, Hong R, Lu Q, Ohno H, Wang JY. Role of the IgM Fc Receptor in Immunity and Tolerance. Frontiers in Immunology. 2019, 10: 529. PMC 6438924
 . PMID 30967868. doi:10.3389/fimmu.2019.00529
. PMID 30967868. doi:10.3389/fimmu.2019.00529  .
.
- ^ Selvaraj P, Fifadara N, Nagarajan S, Cimino A, Wang G. Functional regulation of human neutrophil Fc gamma receptors. Immunologic Research. 2004, 29 (1–3): 219–30. PMID 15181284. S2CID 85351071. doi:10.1385/IR:29:1-3:219.
- ^ Sulica A, Chambers WH, Manciulea M, Metes D, Corey S, Rabinowich H, Whiteside TL, Herberman RB. Divergent signal transduction pathways and effects on natural killer cell functions induced by interaction of Fc receptors with physiologic ligands or antireceptor antibodies. Natural Immunity. 1995, 14 (3): 123–33. PMID 8832896.
- ^ Sarfati M, Fournier S, Wu CY, Delespesse G. Expression, regulation and function of human Fc epsilon RII (CD23) antigen. Immunologic Research. 1992, 11 (3–4): 260–72. PMID 1287120. S2CID 83698996. doi:10.1007/BF02919132.
- ^ Raghavan M, Bjorkman PJ. Fc receptors and their interactions with immunoglobulins (PDF). Annual Review of Cell and Developmental Biology. 1996, 12: 181–220. PMID 8970726. doi:10.1146/annurev.cellbio.12.1.181.
- ^ 23.0 23.1 Swanson JA, Hoppe AD. The coordination of signaling during Fc receptor-mediated phagocytosis. Journal of Leukocyte Biology. December 2004, 76 (6): 1093–103. PMID 15466916. S2CID 13912335. doi:10.1189/jlb.0804439. hdl:2027.42/141562
 .
.
- ^ Sun PD. Structure and function of natural-killer-cell receptors. Immunologic Research. 2003, 27 (2–3): 539–48 [2022-12-03]. PMID 12857997. S2CID 29921323. doi:10.1385/IR:27:2-3:539. (原始內容存檔於2022-12-03).
- ^ Dushek O, Goyette J, van der Merwe PA. Non-catalytic tyrosine- phosphorylated receptors. Immunological Reviews. November 2012, 250 (1): 258–276. PMID 23046135. S2CID 1549902. doi:10.1111/imr.12008.
- ^ Cambier JC. New nomenclature for the Reth motif (or ARH1/TAM/ARAM/YXXL). Immunology Today. February 1995, 16 (2): 110. PMID 7888063. doi:10.1016/0167-5699(95)80105-7.
- ^ Huang ZY, Hunter S, Kim MK, Indik ZK, Schreiber AD. The effect of phosphatases SHP-1 and SHIP-1 on signaling by the ITIM- and ITAM-containing Fcgamma receptors FcgammaRIIB and FcgammaRIIA. Journal of Leukocyte Biology. June 2003, 73 (6): 823–9. PMID 12773515. S2CID 14502303. doi:10.1189/jlb.0902454
 .
.
- ^ Cambier JC. Inhibitory receptors abound?. Proceedings of the National Academy of Sciences of the United States of America. June 1997, 94 (12): 5993–5. Bibcode:1997PNAS...94.5993C. PMC 33673
 . PMID 9177155. doi:10.1073/pnas.94.12.5993
. PMID 9177155. doi:10.1073/pnas.94.12.5993  .
.
- ^ Takai T, Ono M, Hikida M, Ohmori H, Ravetch JV. Augmented humoral and anaphylactic responses in Fc gamma RII-deficient mice. Nature. January 1996, 379 (6563): 346–9. Bibcode:1996Natur.379..346T. PMID 8552190. S2CID 4364705. doi:10.1038/379346a0.
- ^ Coggeshall KM. Inhibitory signaling by B cell Fc gamma RIIb. Current Opinion in Immunology. June 1998, 10 (3): 306–12. PMID 9638367. doi:10.1016/s0952-7915(98)80169-6.
- ^ Joshi T, Butchar JP, Tridandapani S. Fcgamma receptor signaling in phagocytes. International Journal of Hematology. October 2006, 84 (3): 210–6. PMID 17050193. S2CID 6501210. doi:10.1532/IJH97.06140.
- ^ Trinchieri G, Valiante N. Receptors for the Fc fragment of IgG on natural killer cells. Natural Immunity. 1993, 12 (4–5): 218–34. PMID 8257828.
- ^ Sulica A, Galatiuc C, Manciulea M, Bancu AC, DeLeo A, Whiteside TL, Herberman RB. Regulation of human natural cytotoxicity by IgG. IV. Association between binding of monomeric IgG to the Fc receptors on large granular lymphocytes and inhibition of natural killer (NK) cell activity. Cellular Immunology. April 1993, 147 (2): 397–410. PMID 8453679. doi:10.1006/cimm.1993.1079.
- ^ Yamasaki S, Saito T. Regulation of mast cell activation through FcepsilonRI. Chemical Immunology and Allergy. 2005, 87: 22–31. ISBN 3-8055-7948-9. PMID 16107760. doi:10.1159/000087568.
- ^ Wakahara S, Fujii Y, Nakao T, Tsuritani K, Hara T, Saito H, Ra C. Gene expression profiles for Fc epsilon RI, cytokines and chemokines upon Fc epsilon RI activation in human cultured mast cells derived from peripheral blood. Cytokine. November 2001, 16 (4): 143–52. PMID 11792124. doi:10.1006/cyto.2001.0958.
- ^ Metcalfe DD, Baram D, Mekori YA. Mast cells. Physiological Reviews. October 1997, 77 (4): 1033–79. PMID 9354811. doi:10.1152/physrev.1997.77.4.1033.
- ^ David JR, Butterworth AE, Vadas MA. Mechanism of the interaction mediating killing of Schistosoma mansoni by human eosinophils. The American Journal of Tropical Medicine and Hygiene. September 1980, 29 (5): 842–8. PMID 7435788. doi:10.4269/ajtmh.1980.29.842.
- ^ Capron M, Soussi Gounni A, Morita M, Truong MJ, Prin L, Kinet JP, Capron A. Eosinophils: from low- to high-affinity immunoglobulin E receptors. Allergy. 1995, 50 (25 Suppl): 20–3. PMID 7677229. S2CID 36197719. doi:10.1111/j.1398-9995.1995.tb04270.x.
- ^ Gounni AS, Lamkhioued B, Ochiai K, Tanaka Y, Delaporte E, Capron A, Kinet JP, Capron M. High-affinity IgE receptor on eosinophils is involved in defence against parasites. Nature. January 1994, 367 (6459): 183–6. Bibcode:1994Natur.367..183S. PMID 8114916. S2CID 4331405. doi:10.1038/367183a0.
- ^ Pichler WJ, Lum L, Broder S. Fc-receptors on human T lymphocytes. I. Transition of Tgamma to Tmu cells. J Immunol. 1978, 121 (4): 1540–1548. PMID 308968.
- ^ Sandor M, Lynch RG. Lymphocyte Fc receptors: the special case of T cells. Immunol. Today. May 1993, 14 (5): 227–31. PMID 8517922. doi:10.1016/0167-5699(93)90168-K.
- ^ Engelhardt W, Matzke J, Schmidt RE. Activation-dependent expression of low affinity IgG receptors Fc gamma RII(CD32) and Fc gamma RIII(CD16) in subpopulations of human T lymphocytes. Immunobiology. 1995, 192 (5): 297–320. PMID 7649565. doi:10.1016/s0171-2985(11)80172-5.
- ^ Moretta L, Webb SR, Grossi CE, Lydyard PM, Cooper MD. Functional analysis of two human T-cell subpopulations: help and suppression of B-cell responses by T cells bearing receptors for IgM or IgG. J Exp Med. 1977, 146 (1): 184–200. PMC 2180738
 . PMID 301544. doi:10.1084/jem.146.1.184.
. PMID 301544. doi:10.1084/jem.146.1.184.
- ^ 44.0 44.1 Chauhan AK, Moore TL. T cell activation by terminal complex of complement and immune complexes. The Journal of Biological Chemistry. 2011, 286 (44): 38627–38637. PMC 3207419
 . PMID 21900254. doi:10.1074/jbc.M111.266809
. PMID 21900254. doi:10.1074/jbc.M111.266809  .
.
- ^ Sandor M, Lynch RG. Lymphocyte Fc receptors: the special case of T cells. Immunology Today. 1993, 14 (5): 227–231. PMID 8517922. doi:10.1016/0167-5699(93)90168-K.
- ^ Nimmerjahn F, Ravetch JV. Fcgamma receptors as regulators of immune responses. Nat. Rev. Immunol. January 2008, 8 (1): 34–47. PMID 18064051. S2CID 34597359. doi:10.1038/nri2206.
- ^ 47.0 47.1 Bruhns P, Jönsson F. Mouse and human FcR effector functions. Immunol. Rev. November 2015, 268 (1): 25–51. PMID 26497511. S2CID 19544801. doi:10.1111/imr.12350.
- ^ 48.0 48.1 Chauhan AK, Moore TL, Bi Y, Chen C. FcγRIIIa-Syk Co-signal Modulates CD4+ T-cell Response and Up-regulates Toll-like Receptor (TLR) Expression. J. Biol. Chem. January 2016, 291 (3): 1368–86. PMC 4714221
 . PMID 26582197. doi:10.1074/jbc.M115.684795
. PMID 26582197. doi:10.1074/jbc.M115.684795  .
.
- ^ Chauhan AK, Chen C, Moore TL, DiPaolo RJ. Induced expression of FcγRIIIa (CD16a) on CD4+ T cells triggers generation of IFN-γhigh subset. J. Biol. Chem. February 2015, 290 (8): 5127–40. PMC 4335247
 . PMID 25556651. doi:10.1074/jbc.M114.599266
. PMID 25556651. doi:10.1074/jbc.M114.599266  .
.
- ^ Chauhan AK, Moore TL. Immune complexes and late complement proteins trigger activation of Syk tyrosine kinase in human CD4(+) T cells. Clin Exp Immunol. 2012, 167 (2): 235–245. PMC 3278689
 . PMID 22235999. doi:10.1111/j.1365-2249.2011.04505.x.
. PMID 22235999. doi:10.1111/j.1365-2249.2011.04505.x.
- ^ 51.0 51.1 51.2 Chauhan AK, Chen C, Moore TL, DiPaolo RJ. Induced expression of FcγRIIIa (CD16a) on CD4+ T cells triggers generation of IFN-γhigh subset. J. Biol. Chem. February 2015, 290 (8): 5127–40. PMC 4335247
 . PMID 25556651. doi:10.1074/jbc.M114.599266
. PMID 25556651. doi:10.1074/jbc.M114.599266  .
.
- ^ 52.0 52.1 Holgado MP, Sananez I, Raiden S, Geffner JR, Arruvito L. CD32 Ligation Promotes the Activation of CD4+ T Cells. Front Immunol. 2018, 9: 2814. PMC 6284025
 . PMID 30555482. doi:10.3389/fimmu.2018.02814
. PMID 30555482. doi:10.3389/fimmu.2018.02814  .
.
- ^ Chauhan AK, Moore TL, Bi Y, Chen C. FcγRIIIa-Syk Co-signal Modulates CD4+ T-cell Response and Up-regulates Toll-like Receptor (TLR) Expression. J. Biol. Chem. January 2016, 291 (3): 1368–86. PMC 4714221
 . PMID 26582197. doi:10.1074/jbc.M115.684795
. PMID 26582197. doi:10.1074/jbc.M115.684795  .
.
- ^ Chauhan AK. FcgammaRIIIa Signaling Modulates Endosomal TLR Responses in Human CD4+ T Cells. J Immunol. 2017, 198 (12): 4596–4606. PMC 5505339
 . PMID 28500073. doi:10.4049/jimmunol.1601954.
. PMID 28500073. doi:10.4049/jimmunol.1601954.
- ^ 55.0 55.1 Bour-Jordan H, Esensten JH, Martinez-Llordella M, Penaranda C, Stumpf M, Bluestone JA. Intrinsic and extrinsic control of peripheral T-cell tolerance by costimulatory molecules of the CD28/ B7 family. Immunol Rev. 2011, 241 (1): 180–205. PMC 3077803
 . PMID 21488898. doi:10.1111/j.1600-065X.2011.01011.x.
. PMID 21488898. doi:10.1111/j.1600-065X.2011.01011.x.
- ^ Weber JP, Fuhrmann F, Feist RK, Lahmann A, Al Baz MS, Gentz LJ, Vu Van D, Mages HW, Haftmann C, Riedel R, Grun JR, Schuh W, Kroczek RA, Radbruch A, Mashreghi MF, Hutloff A. ICOS maintains the T follicular helper cell phenotype by down-regulating Kruppel-like factor 2. The Journal of Experimental Medicine. 2015, 212 (2): 217–233. PMC 4322049
 . PMID 25646266. doi:10.1084/jem.20141432.
. PMID 25646266. doi:10.1084/jem.20141432.
拓展閱讀
[編輯]- Janeway CA, Travers P, Waldport M, Shlomchik MJ. Chapter 9. The Humoral Immune Response. Immunobiology: The Immune System in Health and Disease
 5th. New York: Garland. 2001. ISBN 978-0-8153-3642-6.
5th. New York: Garland. 2001. ISBN 978-0-8153-3642-6. - Abbas AK, Lichtman AH, Pillai S. Chapter 12: Effector Mechanisms of Humoral Immunity. Cellular and molecular immunology 7th. Philadelphia: Elsevier/Saunders. 2012. ISBN 978-1-4377-1528-6.
- Gerber JS, Mosser DM. Stimulatory and inhibitory signals originating from the macrophage Fcgamma receptors. Microbes and Infection. February 2001, 3 (2): 131–9. PMID 11251299. doi:10.1016/s1286-4579(00)01360-5.
- Maverakis E, Kim K, Shimoda M, Gershwin ME, Patel F, Wilken R, Raychaudhuri S, Ruhaak LR, Lebrilla CB. Glycans in the immune system and The Altered Glycan Theory of Autoimmunity: a critical review. Journal of Autoimmunity. February 2015, 57: 1–13. PMC 4340844
 . PMID 25578468. doi:10.1016/j.jaut.2014.12.002.
. PMID 25578468. doi:10.1016/j.jaut.2014.12.002.
