準性生殖

準性生殖[註 1](英語:parasexual cycle)又稱類有性生殖、擬有性生殖,是某些真菌特有的一種生殖機制,菌絲或酵母菌進行胞質融合與核融合後,不進行減數分裂,亦不形成子實體與孢子,而是在多次有絲分裂中逐漸丟失染色體,恢復成原本的倍性[1],過程中可使染色體重新分配到不同子細胞中,且有絲分裂時可能有互換發生而導致基因重組,增加真菌的遺傳多樣性。準性生殖最初於1953年由義大利遺傳學家基多·龐蒂科夫在小巢狀麴菌中發現,為兩個單倍體經核融合形成二倍體後,經多次有絲分裂漸恢復成單倍體[2][3]。有些可行準性生殖的真菌也可進行正常的有性生殖,經減數分裂產生孢子,白色念珠菌則沒有被觀察到正常有性生殖的現象,只能進行無性生殖與準性生殖,這種真菌在正常狀態下即為二倍體,核融合後會變成四倍體,再經多次有絲分裂恢復為二倍體(或與二倍體相近的非整倍體)[4]。
過程
真菌菌絲體的兩菌絲發生胞質融合,使來自不同菌絲的細胞核集中到同一細胞中,如果兩者細胞核的遺傳組成不同(可能因其來自不同品系的菌絲體,或是有突變發生),即產生異核體,隨後細胞核進一步核融合產生雙倍體,雙倍體的細胞核在多輪有絲分裂中,可能產生染色體交叉而有互換發生(但機率比減數分裂中的互換低上許多),使染色體間發生基因重組。雙倍體的細胞核可能在有絲分裂中發生染色體不分離的現象而產生非整倍體的子細胞,非整倍體的染色體不穩定,容易在後續的有絲分裂中丟失更多染色體,而經多次染色體丟失後回復到原本的染色體倍性(即單倍體)[5][6]。
白色念珠菌的準性生殖
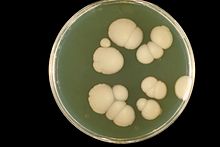
目前仍沒有觀察到白色念珠菌能進行有性生殖,過去認為這種真菌只能以無性生殖繁殖,現代研究則發現它亦可進行準性生殖[7]。不同於多數真菌以單倍體的型式存在,白色念珠菌為二倍體,因此其準性生殖不同於其他真菌為單倍體-二倍體-單倍體的過程,而是二倍體-四倍體-二倍體[註 2]。有研究顯示環境的壓力可以促進白色念珠菌進行準性生殖[9]。
實驗室常用白色念珠菌菌株的MTL基因型[註 3]為a/α,不能進行交配,以基因技術將a或α基因剔除,產生MTLa與MTLα的菌株後,兩者可以交配形成四倍體以進行準性生殖[11]。另外,混濁型(opaque)的白色念珠菌發生交配的機率遠高於白色型(white)的白色念珠菌,且由於a基因與α基因同時存在時會抑制白色型轉換為混濁型,正常情況下只有MTLa與MTLα的菌株可以進行此轉換[12]。
交配
白色念珠菌交配的過程與釀酒酵母類似,混濁型的白色念珠菌中,a交配型可以釋放MFa費洛蒙,為一被異戊二烯化的短肽,α交配型則可釋放MFα費洛蒙,為一未被修飾的短肽。交配時兩交配型的費洛蒙一種經異戊二烯化,一種未被修飾的情形是子囊菌門真菌的共同特徵。而細胞表面供兩費洛蒙結合的受體ste2與ste3亦與釀酒酵母的同源,費洛蒙結合後會使細胞週期停滯於G1期,並使細胞變形延展,最終導致細胞核的融合[12]。這些交配的訊息傳遞路徑還會導致「性菌膜」(sexual biofilm)的形成,性菌膜與正常的生物薄膜成份不同,有助提升交配的效率[7][13]。交配後白色念珠菌將從混濁型回復成白色型,因為其同時具有a基因與α基因,會抑制與混濁型相關的基因表現[14]。
除了不同交配型(a與α)間的交配外,亦有研究結果表明缺乏Bar1蛋白酶的白色念珠菌菌株可以進行同性交配(a與a或α與α)。Bar1蛋白酶的正常功能是降解MTLa菌株所分泌的α費洛蒙,因此當Bar1缺失時,此α費洛蒙可產生自分泌作用,與自身細胞表面的ste2受體結合,啟動細胞中與交配有關的基因表現,而造成同性交配的結果[12][15]。同性交配後白色念珠菌可以維持混濁型的狀態[14]。
分裂
白色念珠菌交配後形成一四倍體,四倍體在某些環境下不穩定,在有絲分裂時可能發生染色體不分離而產生非整倍體,進而在多次有絲分裂後回復為二倍體(或與二倍體相近的非整倍體)[4],且染色體缺失的過程有協同效應,即丟失數個染色體後,在後續的有絲分裂中繼續丟失其他染色體的機率會提升[16]。
細胞進行減數分裂時,Spo11蛋白可以切割DNA而造成雙股斷裂,促使同源染色體間發生同源重組,白色念珠菌雖無減數分裂,但在其準性生殖中,Spo11蛋白亦在有絲分裂時促使有限的基因重組發生[4][7]。
演化意義

有研究結果顯示經長期培養後,同源二倍體的小巢狀麴菌有較單倍體者高的適存度,可能是二倍體提供篩選隱性突變的環境,使多個存在符號上位效應(sign epistasis),即單獨存在有害,但同時存在時能給個體帶來好處的隱性突變得以並存,並在轉為單倍體時分配到同一個個體中[17]。
白色念珠菌的多數菌株均為MTLa/α型而無法交配,正常情況下只有因雜合性丟失而失去其中一個基因,轉為a或α型後才可互相交配,這種現象可能是為了使基因組中累積過多有害突變的個體有機會透過交配進行基因重組,當突變不斷累積,使MTL基因座也發生雜合性丟失時,此個體便獲得交配能力,經過染色體重新組合後有機會提升其適存度,消除有害突變帶來的負面影響[18]。另外,相較於會產生大量孢子的有性生殖,準性生殖不會產生孢子,可以避免刺激宿主的免疫系統對真菌發動攻擊;且相較於有性生殖產生的子細胞染色體倍性固定,準性生殖常會產生非整倍體,可以產生更大的基因多樣性以選汰出對環境適應較佳的個體[7],例如有一項研究顯示白色念珠菌非整倍體菌株的某一個額外染色體片段可以增加其對氟康唑的抗性[12][19]。
應用
在遺傳學中,以互換率判定不同基因在染色體間的位置,是判定基因的連鎖群與測定基因輿圖的重要方式,但許多真菌因不能進行有性生殖而使無法使用此方法,此時即可以準性生殖判定基因間的連鎖群,即判定哪些基因位於同一條染色體上,因有絲分裂互換的發生率很低,通常不影響連鎖群的判斷,也可以利用紫外線照射增加有絲分裂互換的頻率,使其高到足以用來判定基因間的距離[2]。而在同時具有有性生殖與準性生殖的真菌中,可同時使用兩者產生的子代表型分布來判定基因的連鎖群與輿圖[5]。
為促進異核體的形成,可以先將菌絲經人工處理成原生質體,此法在許多真菌中都可促使準性生殖發生[20]。
物種
除了小巢狀麴菌與白色念珠菌外,還有黃麴霉、煙麴黴、醬油麴黴、米麴菌、寄生麴黴、棉黃萎病菌、尖孢鐮刀菌、大麗輪枝菌[21]、產黃青黴菌、稻熱病菌[22]、花葯黑粉菌[2]、育旋孢腔菌與熱帶念珠菌[23]等真菌都已被發現可以進行準性生殖,其中有許多物種過去屬於不完全菌[5]。
註腳
參考資料
- ^ Alexopoulos CJ, Mims CW, Blackwell M. Introductory Mycology. John Wiley and Sons. 1996: 196–97. ISBN 0-471-52229-5.
- ^ 2.0 2.1 2.2 E.D.Garber; M.Ruddat. Transmission Genetics of Microbotryum violaceum (Ustilago violacea): A Case History. Advances in Applied Microbiology. 2002, 51: 107-127. doi:10.1016/S0065-2164(02)51003-0.
- ^ G.Pontecorvo, J.A.Roper, L.M.Chemmons, K.D.Macdonald, A.W.J.Bufton. The Genetics of Aspergillus nidulans 5. Advances in Genetics: 141-248. 1953. doi:10.1016/S0065-2660(08)60408-3.
- ^ 4.0 4.1 4.2 Anja Forche, Kevin Alby, Dana Schaefer, Alexander D Johnson, Judith Berman, Richard J Bennett. The Parasexual Cycle in Candida albicans Provides an Alternative Pathway to Meiosis for the Formation of Recombinant Strains. PLOS Biology. 2008, 6 (5): e110. doi:10.1371/journal.pbio.0060110.
- ^ 5.0 5.1 5.2 Cees Bos. Fungal Genetics: Principles and Practice. CRC Press: 74-87. 1996 [2019-02-18]. ISBN 082479544X. (原始内容存档于2019-02-21).
- ^ Deacon J. Fungal Biology. Cambridge, MA: Blackwell Publishers. 2005: 167–68. ISBN 1-4051-3066-0.
- ^ 7.0 7.1 7.2 7.3 7.4 Richard J Bennett. The parasexual lifestyle of Candida albicans. Current Opinion in Microbiology. 2015, 28: 10-17. doi:10.1016/j.mib.2015.06.017.
- ^ Meleah A. Hickman, Guisheng Zeng, Anja Forche, Matthew P. Hirakawa, Darren Abbey, Benjamin D. Harrison, Yan-Ming Wang, Ching-hua Su, Richard J. Bennett, Yue Wang, Judith Berman. The ‘obligate diploid’ Candida albicansforms mating-competent haploids. Nature. 2013, 494 (7435): 55-59. doi:10.1038/nature11865.
- ^ Judith Berman; Lilach Hadany. Does stress induce (para)sex? Implications for Candida albicans evolution. Trend in Genetics. 2012, 28 (5): 197-203. doi:10.1016/j.tig.2012.01.004.
- ^ Magee BB, Legrand M, Alarco AM, Raymond M, Magee PT. Many of the genes required for mating in Saccharomyces cerevisiae are also required for mating in Candida albicans. Molecular Microbiology. 2002, 46 (5): 1345-1351. doi:10.1046/j.1365-2958.2002.03263.x.
- ^ Christina M. Hull, Ryan M. Raisner, Alexander D. Johnson. Evidence for Mating of the "Asexual" Yeast Candida albicans in a Mammalian Host. Science. 2000, 289 (5477): 307-310. doi:10.1126/science.289.5477.307.
- ^ 12.0 12.1 12.2 12.3 Kevin Alby; Richard J. Bennett. Sexual reproduction in the Candida clade: cryptic cycles, diverse mechanisms, and alternative functions. Cell Mol Life Sci.. 2010, 67 (19): 3275–3285. doi:10.1007/s00018-010-0421-8.
- ^ Yang-Nim Park, Karla J. Daniels, Claude Pujol, Thyagarajan Srikantha, David R. Soll. Candida albicans Forms a Specialized “Sexual” as Well as “Pathogenic” Biofilm. Eukaryotic Cell. 2013, 12 (8): 1120-1131. doi:10.1128/EC.00112-13.
- ^ 14.0 14.1 Theodore Friedmann, Jay C. Dunlap, Stephen F. Goodwin. Advances in Genetics 85. Academic Press. 2014: 273 [2019-02-21]. ISBN 0128003707. (原始内容存档于2019-02-21).
- ^ Kevin Alby, Dana Schaefer, Richard J. Bennett. Homothallic and heterothallic mating in the opportunistic pathogen Candida albicans. Nature. 2009, 460 (7257): 890-893. doi:10.1038/nature08252.
- ^ Richard J. Bennett; Alexander D. Johnson. Completion of a parasexual cycle in Candida albicans by induced chromosome loss in tetraploid strains. The EMBO Journal: 2505-2515. doi:10.1093/emboj/cdg235.
- ^ Sijmen E Schoustra, Alfons J. M Debets, Marijke Slakhorst, Rolf F Hoekstra. Mitotic Recombination Accelerates Adaptation in the Fungus Aspergillus nidulans. PLoS Genetics. 2007, 3 (4): e68. doi:10.1371/journal.pgen.0030068.
- ^ Jan Schmid, Paul T. Magee, Barbara R. Holland, Ningxin Zhang, Richard D. Cannon, Beatrice B. Magee. Last hope for the doomed? Thoughts on the importance of a parasexual cycle for the yeast Candida albicans. Current Genetics. 2015, 62 (1): 81-85. doi:10.1007/s00294-015-0516-8.
- ^ Anna Selmecki1; Anja Forche1; Judith Berman. Aneuploidy and isochromosome formation in drug-resistant Candida albicans. Science. 2006, 313 (5785): 367-370. doi:10.1126/science.1128242.
- ^ M. J. Daboussi; C. Gerlinger. Parasexual cycle and genetic analysis following protoplast fusion in Nectria haematococca. Current Genetics 21. Springer. 1992: 385-392. doi:10.1007/BF00351699.
|issue=被忽略 (帮助) - ^ L. W. O'GARRO; J. M. CLARKSON. Variation for pathogenicity on tomato among parasexual recombinants of Verticillium dahliae. Plant Pathology. 1992, 41 (2): 141-147. doi:10.1111/j.1365-3059.1992.tb02331.x.
- ^ Zeigler RS, Scott RP, Leung H, Bordeos AA, Kumar J, Nelson RJ. Evidence of parasexual exchange of DNA in the rice blast fungus challenges its exclusive clonality. Phytopathology. 1997, 87: 284–94. doi:10.1094/phyto.1997.87.3.284.
- ^ Riyad N. H. Seervai, Stephen K. Jones, Jr., Matthew P. Hirakawa, Allison M. Porman, Richard J. Bennett. Parasexuality and Ploidy Change in Candida tropicalis. Eukaryotic Cell. 2013, 12 (12): 1629-1640. doi:10.1128/EC.00128-13.
| |||||||||||||||||
