碳酸氢盐
外观
| 碳酸氢盐 | |
|---|---|
| |

| |
| 识别 | |
| CAS号 | 71-52-3 |
| PubChem | 769 |
| ChemSpider | 749 |
| SMILES |
|
| Beilstein | 3903504 |
| Gmelin | 49249 |
| 3DMet | B00080 |
| ChEBI | 17544 |
| KEGG | C00288 |
| 性质 | |
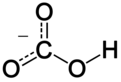
| 化学式 | HCO− 3 |
| 摩尔质量 | 61.0168 g·mol⁻¹ |
| log P | −0.82 |
| pKa | 10.3 |
| pKb | 7.7 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
碳酸氢盐是碳酸形成的酸式盐,含有碳酸氢根离子—HCO3−。大多数碳酸氢盐对热不稳定,会分解为碳酸盐、二氧化碳和水。碱金属碳酸氢盐溶于水,水溶液呈碱性,与酸迅速反应放出二氧化碳气体,加碱则得到相应的正盐碳酸盐。
钾、钠和铵的碳酸氢盐溶解度都小于相应的正盐,这是由于HCO3−通过氢键形成多聚链状离子。
碳酸氢根在生理学上也有很重要的作用,血液中含有H2CO3-HCO3−组成的缓冲溶液,以抵御大幅度的pH值变化,为酶等生物分子维持适宜的酸碱度。[1]
碳酸氢根(HCO3−)为平面结构,碳位于中心,与三个氧原子键连。它是碳酸的共轭碱,也是碳酸根离子的共轭酸。水溶液中存在下列平衡,碳酸氢根既可发生电离生成水合氢离子,也会水解出氢氧根离子,水解程度大于电离,因此水溶液呈弱碱性。
- CO32− + 2 H2O ⇋ HCO3− + H2O + OH− ⇋ H2CO3 + 2 OH−
- H2CO3 + 2 H2O ⇋ HCO3− + H3O+ + H2O ⇋ CO32− + 2 H3O+
檢驗
[编辑]碳酸氫鹽在受熱時會分解,生成二氧化碳。它們也會跟稀氫氯酸反應生成二氧化碳。
例子
[编辑]参见
[编辑]参考资料
[编辑]- ^ http://www.biology.arizona.edu/biochemistry/problem_sets/medph/intro.html (页面存档备份,存于互联网档案馆)
Biology.arizona.edu - October 2006. Clinical correlates of pH levels: bicarbonate as a buffer.
外部連接
[编辑]
| ||||||||
| ||||||||||||||||||||||||||
