热力学系统
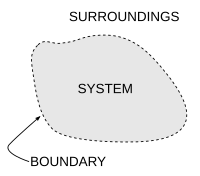
热力学系统(英语:Thermodynamic system)是指用于热力学研究的有限宏观区域,是热力学的研究对象。[1]它的外部空间被称为这个系统的环境。一个系统的边界将系统与它的外部隔开。这个边界既可以是真实存在的,也可以是假想出来的,但必须将这个系统限制在一个有限空间里。系统与其环境可以在边界进行物质、功、热或其它形式能量的传递。而热力学系统可以从它的边界(或边界的一部分)所允许的传递类型进行分类。
热力学系统有一系列的状态函数,比如体积,压强,温度等。这些量都是可以通过实验测量的宏观量。这些量的数值共同决定这个系统的热力学状态。一个热力学系统的状态函数通常存在一个或多个函数关系。这些关系可由状态方程表述。平衡热力学不涉及对这些状态函数的通量的研究。因为由热力学平衡的定义可以自然得到,这些函数的通量的值为零。当然,平衡热力学可能会涉及使通量不为零的过程,但在热力学过程进行前,这些过程必需停止。非平衡热力学允许状态函数通量不为零。通量不为零表示在系统和它的环境间存在物质,能量或熵等的传递。[2]
孤立系统是一种假想存在的系统。这种系统与其外界无任何相互作用。在理想状况下,其内部处于热力学平衡,即它的热力学状态不随时间变化。而非孤立系统根据它的边界的性质可以与它的环境处于热力学平衡。它们也可能处于时时变化或者循环变化(一种稳态)的非平衡状态。系统与其环境的相互作用可以通过热传递或者长程力等方式进行。
热力学系统并非一个普遍概念,并不能代表全部的物理学系统。而这里定义的热力学系统的物理存在可以认为是平衡热力学的基础公设,尽管并没有被列为一条热力学定律。[3][4]而在一些文献中,热力学第零定律通常的表述被认为是这一公设的一个推论。[5]
热力学系统的概念可以追溯到1824年尼古拉·卡诺对于热机的研究。他当时称其为热机的工作物质。
| 热力学 |
|---|
 |
历史
[编辑]首先发展热力学系统这一概念是法国物理学家尼古拉·卡诺。在其于1824年发表的《论火的动力》中,他研究了热机中的“工作物质”,例如蒸汽机中的水蒸气。他通过这一称法来表现这类物质在加热时能对外做功的性质。工作物质通常与高、低温热源和活塞(工作物质通过推动它对外做功)接触。1850年,德国物理学家鲁道夫·克劳修斯在这一基础上,增加了工作物质的环境的概念,并将热力学系统称为“做功体”。在其于1850年的一篇手记《关于火的推动力》(On the Motive Power of Fire)中,他写道:
| “ | 每当(做功体)的体积发生变化,气体对外界或者外界对气体必定要做一定量的功,这是由于气体在膨胀时会克服外界的压力,而其体积的收缩必须要在外界对其施加一定的压力时才能实现。而依据我们遵从的原理,在气体对外界或外界对气体做这份额外的功时,必然会对应消耗或产生一定比例的额外的热量,而气体向“外界介质”并不能释放与其吸收的相当的热量。 | ” |

边界和环境
[编辑]系统的边界是包围或标定热力学系统所占据空间区域的,物质、热量或功等等的量可以流过的,实际存在的或假想出来的二维闭合曲面。[6]简言之,热力学系统的边界是系统与环境的几何分界。 从拓扑学角度考虑, 它通常与一个二维球面同胚或分段同胚,因为热力学系统的空间结构通常是单连通的。
系统的边界的形状既可以是不变的(例如一个定容反应器),也可以是可变的(例如活塞结构)。边界既可以是真实存在的,也可以是假想出来的。对于封闭系统而言,其边界通常是真实存在的,而开放系统的边界通常是假想出来的。为了理论研究上的方便,系统的边界会被设定具有绝热,恒温,透热,绝缘,全透,或半透等等性质——但实际上能使边界具有上述较为理想性质的材料可能并不存在。而边界的体积也是可大可小的,例如它可以大到一个热带气旋所占据的空间体积,也可以小到一个夸克系统所所占据的空间体积。
系统指物质世界被特别拿出研究的部分,而其环境是指在其边界外的物质世界其它部分。依据系统的类型,系统可以与其环境发生物质、能量(包括热量和功)、动量、电荷或其他守恒量的传递。除了需要考虑这些作用以外,系统的环境通常在对系统研究时会被忽略。[7]
分类
[编辑]| 热力学系统类型 | 传递方式 | ||
|---|---|---|---|
| 物质 | 功 | 热 | |
| 开放系统 | |||
| 封闭系统 | |||
| 绝热系统 | |||
| 力学孤立系统 | |||
| 孤立系统 | |||
热力学系统依据其边界所允许传递的量进行分类。
孤立系统是彻底孤立于其环境的热力学系统。它不与其环境发生物质或能量的传递。而在实际情况中,彻底孤立于其环境的热力学系统并不存在,因为系统内部与外界多少会存在一定的联系,比如万有引力。
封闭系统是能与其环境传递能量(热量或功)但不能传递物质的热力学系统。通常温室可以看作一个封闭系统,可以与其环境传递能量,不能与其环境传递功。一个系统与外界传递的是热量或机械能或二者同时可以传递,通常取决于其边界的性质。
开放系统是能与其环境传递能量和物质的热力学系统。它的边界的一部分同时允许其与环境进行物质的传递的性质称为“全透性”。
力学孤立系统是指不与其环境传递物质或机械能,但能传递热量的热力学系统。对于一个简单系统,力学孤立等价于其体积固定。系统中发生的过程被称为等容过程。
绝热系统是指不与其环境传递物质或热量,但能传递机械能的热力学系统。系统中发生的过程被称为绝热过程。
开放系统
[编辑]开放系统可以通过其边界的一些部分与外界进行物质传递。其边界其它部分可能只允许能量传递,而并不允许物质传递。同时还需要考虑系统内部各部分间的能量传递。
流动过程
[编辑]
开放系统边界所包围的空间通常称作控制体积。它既可以有也可以没有实际存在的物理边界。为了简化研究,通常可以特别设定控制体积的形状,这样所有的物质流动都可以垂直于其表面进行;或者,设定过程为化学均一的物质流入或流出系统。[8] 流入系统的物质会做功(例如被活塞推入的流体)同时,系统也可以对外做功(例如流体将活塞推出)在系统边界不进行物质传递的部分,可能存在热量 (δQ) 和功(δW)的传递,包括轴功。
经典热力学认为如果没有物质和能量流动,在过程起点和终点,系统都会处于内部热平衡。而如果系统是以一致流速流动的流体,这一点依然成立。而出于简化研究等目的,对于发生流动过程的系统,经典热力学理论依旧可以认为是适用的。[9]在下面的介绍中,将不考虑系统流体动能及重力势能的变化,而系统边界是固定并且不会发生形变。
在这些条件下,依据热力学第一定律,我们可以得到,对于系统:系统的内能变化量等于流入系统的物质的内能加上这一过程中系统吸收热量减去流出系统的物质的内能和系统对外做功总量。数学表达式为:
其中Uin和Uout分别表示随物质流动而流入或流出的平均内能。
于是系统就会做两种类型的功: 如上面所示的对控制体积内流体做的“流动功”(经常也被称为“PV 功”),和控制体积内流体对有轴承的机械做的“轴功”。这两种类型功如下式所示:
代入上面描述控制体积的等式得到:
依据焓的定义,H = U + PV,可以将上式中内能U和PV功联系起来:
而如果系统在过程处于稳态,那么系统的各属性就不会随时间变化。因此,系统的内能就会是个常数,也就是说上式中,dUcv等于零。这样就可以得到一个十分有用的关系:
物质的选择性传递
[编辑]对于一个热力学过程来说,系统的边界和环境的属性十分重要,因为它们决定了这一过程是否能进行。开放系统的边界允许物质传递。而考虑到系统内能的变化,系统与环境的物质传递就需要它们进行热能和机械能之外形式的能量的传递。同时这也导致了化学势概念的产生。
当系统边界只对某种物质全透,那么系统就可以环境中这一物质的扩散源进行扩散式接触,即系统就可以与环境传递这种物质。同时,在边界内外同时存在那种物质的接触平衡。通过适当的热力学操作,物质的扩散源可以被视为一个封闭系统,其内能和熵也可以视为它的温度、压强和摩尔数的函数。
一些热力学操作可以使系统边界不允许某种物质的传递,而不是达到这一物质的接触平衡,因而这就需要一个对应该物质的内含量,化学势。对于系统某一组分i,其化学势记作μi。而这个内含量对应的外延量可以是系统中该组分的摩尔数Ni。
而对于某种物质全透的边界内外处于接触平衡时,其内外该物质化学势必须相等。这是热力学平衡性质的一部分,也可以认为与热力学第零定律有关。[10]
封闭系统
[编辑]封闭系统不会与其环境发生物质传递,但系统会和其环境通过其边界发生热量及机械功的传递。一个系统与外界传递的是热量或机械功或二者同时可以传递,通常取决于其边界的性质。如果系统边界绝热,即其不允许热量传递时,称系统为绝热系统。而当系统边界为刚体时,即其不允许机械功传递时,称系统为力学孤立系统。
压缩冲程中的燃油-空气混合气体是典型的绝热系统。而“弹式热量计”,一种用于测定某些反应的燃烧热的恒容热量计,则是后者的典型例子。在其测量时,电能会从边界流入腔体,在电极间产生电火花触发燃烧。在燃烧后会发生热量传递,但全过程不会发生物质传递。
关于封闭系统的热力学过程的数学表述。首先考察热力学第一定律对于一个开放系统的热力学过程的表述:
其中U是系统的内能,Q是系统吸收的热量,W是系统对外做功,由于不会发生物质传递,上式中有关物质流动的部分可以忽略,由此得到热力学第一定律对于封闭系统的表述:系统内能的变化量等于系统吸收热量减去系统对外做功。而系统的微小变化可以表述为:
如果系统通过在环境压力P下体积膨胀dV方式做功,那么W可以描述为:
对于只能发生可逆过程的内部均一的系统,依据热力学第二定律,Q可以描述为:
其中T是系统的热力学温度,S是系统的熵。考察上述两式,可以得到:
对于其中只有单一粒子(原子或分子)的简单系统,如果它是封闭的,那么意味着它内部的粒子数一定。然而,一个封闭系统如果内部发生化学反应,其内部的分子种类和各自的数量可能在反应过程中发生变化。而从化学反应前后的物质守恒,我们可以看出这并没有影响其中原子(无论构成何种分子)的种类及各种原子的数量,这一点可以通过下式表现:
其中Nj是j分子数量,aij是j中i原子的数量,bi0是i原子的总量(由于系统是封闭的,其是常量)。对于各种原子,此式均成立。
孤立系统
[编辑]孤立系统是与其外界没有任何联系的热力学系统。系统的边界不允许系统与环境进行物质和能量的传递,其物质和能量总量不随时间变化。孤立系统内部压强、温度以及物质分布会均一化。而系统所有的均一化过程最终会使系统达到热力学平衡。
孤立系统在现实中并不存在(唯一的例外可能是宇宙整体),因为系统内部物质和外界物质间会存在像万有引力这样的相互作用。[11][12][13][14][15] 然而,现实中的热力学系统可以在一定时间内处于趋近于孤立的状态。这时孤立系统就可以成为拟合现实世界情况的一个十分有用的模型。而在构造某些现象的数学模型时,它也是一个可以接受的理想化模型。玻尔兹曼在证明H定理(这一定理可以验证熵增加原理)时使用了玻尔兹曼方程。而这一方程只有在系统孤立时才能严格成立。
热力学平衡
[编辑]热力学系统的平衡定义为热力学系统诸属性不随时间变化。通常而言,系统平衡时要比未平衡时容易研究得多。通常在研究一个热力学过程时,可以假设每个中间过程中,系统处于平衡态。这样可以大大简化对于系统的研究分析。
对于可逆过程,其每一阶段也必须是可逆的。而一个过程的可逆阶段中,系统必须时时处于平衡。而这在现实中不能达到,只能通过使过程缓慢进行来趋近,因为过程中的每一阶段在没有打破系统平衡的前提下是不能进行的。
另见
[编辑]参考文献
[编辑]- ^ 秦允豪. 《普通物理学教程 热学》第三版. 高等教育出版社. 2011. ISBN 978-7-04-030090-1.
- ^ Eu, B.C. (2002). Generalized Thermodynamics. The Thermodynamics of Irreversible Processes and Generalized Hydrodynamics, Kluwer Academic Publishers, Dordrecht, ISBN 1-4020-0788-4.
- ^ Bailyn, M. (1994). A Survey of Thermodynamics, American Institute of Physics Press, New York, ISBN 0-88318-797-3, p. 20.
- ^ Tisza, L. (1966). Generalized Thermodynamics, M.I.T Press, Cambridge MA, p. 119.
- ^ Bailyn, M. (1994). A Survey of Thermodynamics, American Institute of Physics Press, New York, ISBN 0-88318-797-3, p. 22.
- ^ Perrot, Pierre. A to Z of Thermodynamics. Oxford University Press. 1998. ISBN 0-19-856552-6.
- ^ The Blue Book on Environment by Richard Dawkins
- ^ Shavit, A., Gutfinger, C. (1995). Thermodynamics. From Concepts to Applications, Prentice Hall, London, ISBN 0-13-288267-1, Chapter 6.
- ^ Adkins, C.J. (1968/1983). Equilibrium Thermodynamics, third edition, Cambridge University Press, Cambridge UK, ISBN 0-521-25445-0, pp. 46–47.
- ^ Bailyn, M. (1994). A Survey of Thermodynamics, American Institute of Physics Press, New York, ISBN 0-88318-797-3, pp. 19–23.
- ^ I.M.Kolesnikov; V.A.Vinokurov; S.I.Kolesnikov. Thermodynamics of Spontaneous and Non-Spontaneous Processes. Nova science Publishers. 2001: 136 [2014-01-30]. ISBN 1-56072-904-X. (原始内容存档于2014-06-27).
- ^ A System and Its Surroundings. ChemWiki. University of California - Davis. [May 2012]. (原始内容存档于2016-02-03).
- ^ Hyperphysics. The Department of Physics and Astronomy of Georgia State University. [May 2012]. (原始内容存档于2019-01-15).
- ^ Bryan Sanctuary. Open, Closed and Isolated Systems in Physical Chemistry,. Foundations of Quantum Mechanics and Physical Chemistry. McGill University (Montreal). [May 2012]. (原始内容存档于2012-05-30).
- ^ Material and Energy Balances for Engineers and Environmentalists (PDF). Imperial College Press. : 7 [May 2012]. (原始内容 (PDF)存档于2009-08-15).
- Abbott, M.M.; van Hess, H.G. Thermodynamics with Chemical Applications 2nd. McGraw Hill. 1989.
- Halliday, David; Resnick, Robert; Walker, Jearl. Fundamentals of Physics 8th. Wiley. 2008.
- Moran, Michael J.; Shapiro, Howard N. Fundamentals of Engineering Thermodynamics 6th. Wiley. 2008.


























