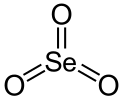
三氧化硒
外觀
| 三氧化硒[1] | |||
|---|---|---|---|
| |||
| 識別 | |||
| CAS號 | 13768-86-0 | ||
| PubChem | 115128 | ||
| ChemSpider | 103019 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | VFLXBUJKRRJAKY-UHFFFAOYAC | ||
| 性質 | |||
| 化學式 | SeO3 | ||
| 莫耳質量 | 126.96 g·mol⁻¹ | ||
| 外觀 | 白色潮解性晶體 | ||
| 密度 | 3.44 g/cm3 | ||
| 熔點 | 118.35 °C | ||
| 沸點 | 升華 | ||
| 溶解性(水) | 溶解度很大 | ||
| 結構 | |||
| 晶體結構 | 四方晶系 | ||
| 危險性 | |||
| 歐盟分類 | |||
| NFPA 704 | |||
| 致死量或濃度: | |||
LD50(中位劑量)
|
7 mg/kg(大鼠,口服) 7.08 mg/kg(小鼠,口服) 5.06 mg/kg(豚鼠,口服) 2.25 mg/kg(兔子,口服) 13 mg/kg(馬,口服)[2] | ||
LC50(中位濃度)
|
13 mg/kg(豬,口服) 9.9 mg/kg(牛,口服) 3.3 mg/kg(山羊,口服) 3.3 mg/kg (綿羊,口服)[2] | ||
| 相關物質 | |||
| 其他陰離子 | 六硫化二硒 | ||
| 其他陽離子 | 三氧化硫 三氧化碲 三氧化釙 | ||
| 相關化學品 | 二氧化硒 硒酸 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
三氧化硒(化學式 SeO3)是硒(VI)的氧化物,為白色潮解性晶體。它也是一種氧化劑和路易斯酸,可以製備其它Se(VI)化合物。[3]
製備
[編輯]三氧化硒難以製備,因為它對分解成二氧化硒的反應並不穩定:
- 2 SeO3 → 2 SeO2 + O2
實驗室通過用無水硒酸鉀(K2SeO4)和三氧化硫反應製備三氧化硒:[4]
- K2SeO4 + SO3 → SeO3 + K2SO4
反應
[編輯]SeO3 的化學性質比起三氧化碲 TeO3,更像三氧化硫 SO3。[3]
在120 °C下,SeO3和二氧化硒反應,形成混合價態化合物五氧化二硒:[5]
- SeO3 + SeO2 → Se2O5
- 2SeO3 + SeF4 → 2SeO2F2 + SeO2
類似SO3,它也能和如吡啶、二氧六環和乙醚的路易斯鹼形成加合物。[3]
它和氧化鋰和氧化鈉反應,形成 SeVIO54− 和SeVIO66−的鹽:[6]它和Li2O的反應會產生Li4SeO5,含有三角雙錐結構的 SeVIO54− 陰離子。水平方向的Se-O鍵長為170.6–171.9 pm,而垂直方向的 Se−O 鍵較長,為 179.5 pm。它和Na2O的反應產生的是 Na4SeO5,其中的 SeVIO54−離子為四方錐結構。它的Se−O 鍵長在172.9 至181.5 pm的範圍內,而Na12(SeO4)3(SeO6)則含有八面體形結構的 SeVIO66−。SeVIO66− 是未知的原硒酸 (Se(OH)6)的共軛鹼。
結構
[編輯]固態的三氧化硒是由環狀的四聚體Se4O12組成的,其中含有(Se-O)4八元環。硒原子是四配位的,橋接 Se−O 鍵長為 175 pm 和181 pm,而非橋接Se-O鍵長則為 156 和154 pm。[6]
氣態中的SeO3則是四聚體和平面三角形構型的 SeO3 單體的混合物,它的 Se−O 鍵長為 168.78 pm。[7]
用途
[編輯]三氧化硒可用於碳氫化合物的溫和硒化。[8]它和氫氟酸反應,可以製備氟硒酸。[9]
參考資料
[編輯]- ^ Lide, David R. Handbook of Chemistry and Physics 87. Boca Raton, Florida: CRC Press. 1998: 4–81. ISBN 0-8493-0594-2.
- ^ 2.0 2.1 Selenium compounds (as Se). Immediately Dangerous to Life and Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ 3.0 3.1 3.2 Egon Wiberg, Arnold Frederick Holleman (2001) Inorganic Chemistry, Elsevier ISBN 0123526515
- ^ Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 422.
- ^ Z. Žák "Crystal structure of diselenium pentoxide Se2O5" Zeitschrift für anorganische und allgemeine Chemie 1980, volume 460, pp. 81–85. doi:10.1002/zaac.19804600108
- ^ 6.0 6.1 Handbook of Chalcogen Chemistry: New Perspectives in Sulfur, Selenium and Tellurium, Franceso A. Devillanova, Royal Society of Chemistry, 2007, ISBN 9780854043668
- ^ Brassington, N. J.; Edwards, H. G. M.; Long, D. A.; Skinner, M. The pure rotational Raman spectrum of SeO3. Journal of Raman Spectroscopy. 1978, 7 (3): 158–160. ISSN 0377-0486. doi:10.1002/jrs.1250070310.
- ^ Max Schmidt, Irmgard Wilhelm: Lösungen von Selentrioxid. In: Chemische Berichte. 97, 1964, S. 872–875, doi:10.1002/cber.19640970334.
- ^ Jane E. Macintyre. Dictionary of Inorganic Compounds. CRC Press. 1992-07: 3128. ISBN 0412301202.