氧化亞鐵
外觀
| 氧化亞鐵 | |
|---|---|

| |

| |
| IUPAC名 Iron(II) oxide 氧化鐵(II) | |
| 別名 | 氧化亞鐵 (ferrous oxide) 一氧化鐵 (iron monoxide) |
| 識別 | |
| CAS號 | 1345-25-1 |
| ChemSpider | 14237 |
| InChIKey | UQSXHKLRYXJYBZ-WPTVXXAFAB |
| Gmelin | 13590 |
| 性質 | |
| 化學式 | FeO |
| 莫耳質量 | 71.85 g·mol⁻¹ |
| 密度 | 5.7 g/cm³ |
| 熔點 | 1370 °C (1643.15 K) |
| 沸點 | 3414 °C (3687.15 K) |
| 溶解性(水) | 不溶 |
| 危險性 | |
| 主要危害 | 引火 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
氧化亞鐵,是鐵的氧化物之一。其外觀呈藍灰色粉末,化學式為FeO,由氧化態為II價的鐵與氧共價結合。它的礦物形式為方鐵礦。氧化亞鐵經常容易與鐵鏽混淆,但鐵鏽的主要成分為水合氧化鐵。氧化亞鐵屬於非整比化合物,其中鐵和氧元素的比例會發生變化,範圍從Fe0.84O到Fe0.95O。[1]
製備
[編輯]FeO可以在隔絕空氣條件下加熱草酸亞鐵製得。
整比的FeO可以通過加熱Fe0.95O與金屬鐵,在770℃和36kbar壓力條件下生成。[3]
FeO也可以在900℃條件下通過氧化鐵與一氧化碳反應(在還原焰中加熱氧化鐵)得到。
相關反應
[編輯]FeO在低於575℃的條件下具有熱不穩定性,可以歧化生成金屬鐵和Fe3O4[1]:
FeO可與一些元素單質反應,而被還原為鐵單質:
結構
[編輯]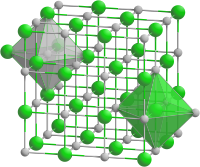
__ Fe2+ __ O2−
氧化亞鐵屬於立方晶系(類似於氯化鈉晶體結構),每個鐵原子周圍連接著6個氧原子形成八面體型配位,每個氧原子周圍也以同樣的情況連接著6個鐵原子。出現非整比化合物的原因在於,由於二價鐵很容易被氧化為三價鐵,導致FeO中少量二價鐵被替換為三價鐵,占據晶格中的四面體空隙。[3]
在低於200K時,氧化亞鐵的晶體結構會發生微小變化,變為菱方,並且具有反鐵磁性。[3]
用途
[編輯]氧化亞鐵可以被用作色素,在化妝品和刺青墨水中都有應用。氧化亞鐵也應用於瓷器製作中使釉呈綠色。
參考資料
[編輯]- ^ 1.0 1.1 Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- ^ Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A.; Bochmann, Manfred (1999). Advanced Inorganic Chemistry (6th Edn.) New York:Wiley-Interscience. ISBN 0-471-19957-5
- ^ 3.0 3.1 3.2 Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford University Press ISBN 0-19-855370-6
參見
[編輯]外部連結
[編輯]
| |||||||||||||||||||||||||||||||||||||||||||||||||||||








