磷酸鹽
| 磷酸鹽 | |||
|---|---|---|---|

| |||
| |||
| 系統名 Phosphate[1] | |||
| 識別 | |||
| CAS號 | 14265-44-2 | ||
| PubChem | 1061 | ||
| ChemSpider | 1032 | ||
| SMILES |
| ||
| Beilstein | 3903772 | ||
| Gmelin | 1997 | ||
| ChEBI | 18367 | ||
| MeSH | Phosphates | ||
| 性質 | |||
| 化學式 | PO3− 4 | ||
| 莫耳質量 | 94.9714 g·mol⁻¹ | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
磷酸鹽(phosphate,符號:PO3−
4),是磷酸的鹽,在無機化學、生物化學及生物地質化學上是很重要的物質。
化學特性
[編輯]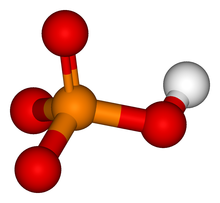
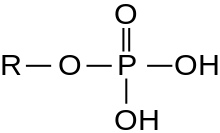
磷酸鹽離子是一個多原子的離子,其實驗式是PO43−,而分子量是94.97。它包含一個磷原子,並由四個氧原子所包圍,形成一個正四面體。磷酸鹽離子帶有-3的形式電荷,且是磷酸氫鹽離子(HPO42−)的共軛鹼;磷酸氫鹽離子則是磷酸二氫鹽離子(H2PO4−)的共軛鹼;而磷酸二氫鹽離子又是磷酸(H3PO4)的共軛鹼。它是一個超價分子(磷原子在其電子層有著10個電子)。如果磷酸鹽作為一種有機磷化合物就被稱為磷酸酯,其化學式為OP(OR)3。
除了一些鹼金屬外,大部份磷酸鹽,在標準狀態下,都是不可溶於水的。
在稀釋的水溶液中,磷酸鹽以四種形式存在。在強鹼環境下,磷酸鹽離子(PO43−)會較多;而在弱鹼的環境下,磷酸氫鹽離子(HPO42−)則較多。在弱酸的環境下,磷酸二氫鹽離子(H2PO4−)較為普遍;而在強酸的環境下,則水溶的磷酸(H3PO4)是主要存在的形式。更精確的就是以下三種平衡反應:
在25℃的環境下有以各種不同的酸度係數(mol/L):
若在強鹼的pH值下(pH=13),可以發現:
可見只有磷酸鹽(PO43−)及磷酸氫鹽(HPO42−)是主要的成份。
若在中和的pH值下(例如原生質,pH=7.0),可以發現:
所以只有磷酸二氫鹽(H2PO4−)及磷酸氫鹽(HPO42−)離子是主要成份(當中62%是H2PO4−,38%是HPO42−)。需要留意的是在細胞外體液(其pH約為7.4),這個比例會倒轉(61%是HPO42−,39%是H2PO4−)。
若在強酸的pH值下(pH=1),可以發現:
可見H3PO4,相較於H2PO4−是最多的。實際上HPO42−及PO43−會接近消失。
磷酸鹽可以形成聚合離子的二磷酸鹽(亦即焦磷酸鹽,P2O74−)、三磷酸鹽(P3O105−)等。多種的偏磷酸鹽離子都有著一個實驗式的PO3−,且是在普遍在多種化合物。
磷酸鹽礦產可以包含大量自然產生的鈾。若吸收了這些土壤改良劑可以引致農作物含有鈾成份。
生理特性
[編輯]磷酸鹽在人體與組織結構、代謝、調節有關,是重要生理生化物質。攝取過多磷酸鹽且血中磷酸鹽過高,則與心血管疾病、腎臟病有關[3]。
磷酸鹽常做為加工食品和速食的添加劑,也普遍存在於調味軟飲料、某些奶製品中,以上食物吃多有礙健康。
出現
[編輯]
磷酸鹽是元素磷自然產生的形態,在多種磷酸鹽礦物中可以找到。元素的磷或是磷化物是很難發現的(只有極少量在隕石中可以找到)。在礦物學及地質學,磷酸鹽是指含有磷酸鹽離子的石或礦石。
在北美洲最大型的磷礦粉礦床位於美國的佛羅里達州中部、愛德荷州的索達斯普陵、北卡羅萊那州沿岸區域。而其次的是位於蒙大拿州、田納西州、喬治亞州及南卡羅萊那州近查爾斯頓。諾魯這個細少的島國就曾經是有著大量高質素的磷酸鹽礦產,但現時已被大量挖掘。磷礦粉亦可以在納弗沙島、摩洛哥、突尼西亞、以色列、多哥及約旦找到,這些地方亦有大量的磷酸鹽礦業。
在生物中,磷是以溶液中游離的磷酸鹽離子的形態出現,稱為「無機磷酸鹽」,這是要與其他在磷酸酯中的磷酸鹽作出區別的。無機磷酸鹽是會以Pi來表示,它可以是由焦磷酸鹽(以PPi來表示)水解而得:
但是,磷酸鹽最普遍是以一磷酸腺苷(AMP)、二磷酸腺苷(ADP)、三磷酸腺苷(ATP)、脫氧核糖核酸(DNA)及核糖核酸(RNA)的形式出現,且可以經由水解ADP或ATP而被釋放出來。對於其他的二磷或三磷核苷亦有相似的反應。在ADP及ATP,或其他二磷及三磷核苷中的磷酸酐鍵,包含著大量的能量,所以它們在生物中有著重要的地位。它們一般會被稱為高能磷酸磷,就像在肌肉組織中的磷酸肌酸一樣。一些如膦的化合物在有機化學上亦會被使用,但它卻似乎沒有自然的相應物。
由於磷酸鹽對生物的重要性,所以在生態學上,它是高度被採集。因此,它在環境中往往是限量試劑,而它的可得性則決定生物成長的速度。將大量的磷酸鹽加入缺乏磷酸鹽的環境或微生物環境中,會對生態有著重大的影響。例如,某一種生物的暴漲會使其他生物死亡。另外耗氧的種群也會消亡(參見富營養化)。在污染的問題下,磷酸鹽是總溶解固體量(一種主要的水質指標)的主要成份。
用途
[編輯]
磷酸鹽一般會用在清潔劑中作為軟水劑,但是因為磷酸鹽的排放會影響藻類的繁榮衰退,所以在某些地區磷酸鹽清潔劑是受到管制的。
在農業上,磷酸鹽是植物的三種主要養份之一,且是肥料的主要成份。磷礦粉是從沉積岩的磷層中開採。以前它在開採後不用加工便可使用,但現時未加工的磷酸鹽只會用在有機耕種上。一般它都是會化學加工製成過磷酸石灰、重過磷酸鈣或磷酸二氫銨,它們的濃度都較磷酸鹽高,且較易溶於水,所以植物可以較快吸收。
肥料級數一般有三個數字:第一個是指氮的數量,第二個是指磷酸鹽的數量(以P2O5作基準),而第三個是指鹼水(以K2O作基準)。所以一個10-10-10的肥料就每種成份各有10%,而其他的則是填充物。
從過度施肥的農地逕流的磷酸鹽會是富營養化、赤潮及其後缺氧的起因。這就像磷酸鹽清潔劑一樣會引起魚類及其他水生生物的缺氧。
參見
[編輯]參考文獻
[編輯]- ^ Phosphates – PubChem Public Chemical Database. The PubChem Project. USA: National Center of Biotechnology Information. [2022-10-21]. (原始內容存檔於2013-05-12).
- ^ Campbell, Neil A.; Reece, Jane B. Biology Seventh Edition. San Francisco, California: Benjamin Cummings. 2005: 65. ISBN 0-8053-7266-4.
- ^ Ritz, Eberhard; Hahn, Kai; Ketteler, Markus; Kuhlmann, Martin K.; Mann, Johannes. Phosphate additives in food--a health risk. Deutsches Ärzteblatt International. January 2012, 109 (4): 49–55. ISSN 1866-0452. PMC 3278747
 . PMID 22334826. doi:10.3238/arztebl.2012.0049.
. PMID 22334826. doi:10.3238/arztebl.2012.0049.
- ^ On-line Objective Analyses and Statistics (HTML/ASCII). World Ocean Atlas 2001. National Oceanographic Data Center, National Oceanographic and Atmospheric Administration. 2003年 [2006年12月6日]. (原始內容存檔於2006年12月12日).
延伸閱讀
[編輯]- Schmittner Karl-Erich; Giresse Pierre. Micro-environmental controls on biomineralization: superficial processes of apatite and calcite precipitation in Quaternary soils. Sedimentology (Roussillon, France). 1999, 46 (3): 463–476.






![{\displaystyle K_{a1}={\frac {[H^{+}][H_{2}PO_{4}^{-}]}{[H_{3}PO_{4}]}}\simeq 7.5\times 10^{-3}{\mbox{,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/62f2ba9ecb9a40ac3fd6a8fd331ae767b184e15b)
![{\displaystyle K_{a2}={\frac {[H^{+}][HPO_{4}^{2-}]}{[H_{2}PO_{4}^{-}]}}\simeq 6.2\times 10^{-8}{\mbox{,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2aa4c779d927d2824aeb308dfbf2c434c297d47e)
![{\displaystyle K_{a3}={\frac {[H^{+}][PO_{4}^{3-}]}{[HPO_{4}^{2-}]}}\simeq 2.14\times 10^{-13}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7201d48dfc7c86493daf34e4679618959fbfebab)
![{\displaystyle {\frac {[H_{2}PO_{4}^{-}]}{[H_{3}PO_{4}]}}\simeq 7.5\times 10^{10}{\mbox{ , }}{\frac {[HPO_{4}^{2-}]}{[H_{2}PO_{4}^{-}]}}\simeq 6.2\times 10^{5}{\mbox{ , }}{\frac {[PO_{4}^{3-}]}{[HPO_{4}^{2-}]}}\simeq 2.14}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fdff155f58159f9fa20d5f444708b238678db3c5)
![{\displaystyle {\frac {[H_{2}PO_{4}^{-}]}{[H_{3}PO_{4}]}}\simeq 7.5\times 10^{4}{\mbox{ , }}{\frac {[HPO_{4}^{2-}]}{[H_{2}PO_{4}^{-}]}}\simeq 0.62{\mbox{ , }}{\frac {[PO_{4}^{3-}]}{[HPO_{4}^{2-}]}}\simeq 2.14\times 10^{-6}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d1afe600453d5c9eb6f5c56b82b40041f0ffe706)
![{\displaystyle {\frac {[H_{2}PO_{4}^{-}]}{[H_{3}PO_{4}]}}\simeq 0.075{\mbox{ , }}{\frac {[HPO_{4}^{2-}]}{[H_{2}PO_{4}^{-}]}}\simeq 6.2\times 10^{-7}{\mbox{ , }}{\frac {[PO_{4}^{3-}]}{[HPO_{4}^{2-}]}}\simeq 2.14\times 10^{-12}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/16ceb2d14a29e6c0e64acfe14f6d4649e10d935c)
