电解
外观
电解(electrolysis)是指将电流通过电解质溶液或熔融态物质,而在阴极和阳极上引起氧化还原反应的过程。电化学电池在接受外加电压(即充电过程)时,会发生电解过程。
举例
[编辑]


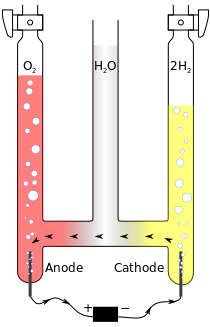
以下为在酸性水溶液中电解水的例子。
- 阳极(anode):
- 阴极(cathode):
总反应式
在这个反应中,阳极产生放出电子的反应(氧化),阴极产生取得电子的反应(还原)。
历史
[编辑]电解的英文electrolysis是由希腊文ἤλεκτρον[ɛ̌ːlektron]“琥珀”和λύσις [lýsis] “溶解”而来。
- 1785年:Martinus van Marum的静电产生器用来从锡、锌、锑的盐类中还原出金属[1]。
- 1800年:William Nicholson和Anthony Carlisle将水电解,产生氢和氧。
- 1807年:汉弗里·戴维利用电解发现钾、钠、钡、钙和镁。
- 1875年:保罗·埃米尔·勒科克·德布瓦博德兰利用电解发现了镓[2]
- 1886年:亨利·莫瓦桑利用电解发现元素氟。
- 1886年:发展了电解制铝的霍尔-埃鲁法。
- 1890年:发展了制备氢氧化钠的卡斯纳-凯耳纳过程。
应用
[编辑]电解可用来进行各种电化学的制备和生产,是重要的工业过程。
- 氯碱工业:电解食盐盐水(氯化钠溶液),阳极产生氯气,阴极产生氢和氢氧化钠溶液。
- 熔盐电解:电负性高的氟和电负性低的钠、钾、钙等碱金属和碱土金属以及各种难熔的金属只能通过相应的熔盐电解才能制得。
- 电冶金:铜、锌等金属可通过电解法从矿石提取液中分离。
- 电解精炼:通过电解精炼可以获得高纯度的金属。
- 电镀、电抛光是重要的金属表面精饰工艺。
- 电解水:将做为饮水用途的自来水(内溶适量中性盐类离子化合物),经净化后电解分离的碱性离子水,及提供作为环保消毒或皮肤外疗的酸性离子水。
- 储能:将水电解为氢气与氧气,将氢气储存起来,做为燃料电池的燃料。
法拉第定律
[编辑]电解过程中,在电极发生化学反应而产生的物质的质量与通过电解质的电量成正比。
- 电量=电流×时间(Q=I·t)
法拉第第二电解定律
[编辑]当相同电量通过不同电解质时,沉积在电极的元素的摩尔数与它的离子所带的电荷大小成反比。
参见
[编辑]参考资料
[编辑]- ^ The Supplement (1803 edition) to Encyclopedia Britannica 3rd edition (1797), volume 1, page 225, "Mister Van Marum, by means of his great electrical machine, decomposed the calces of tin, zinc, and antimony, and resolved them into their respective metals and oxygen" and gives as a reference Journal de Physiques, 1785.
- ^ Sir William Crookes. The Chemical news and journal of industrial science; with which is incorporated the "Chemical gazette.": A journal of practical chemistry in all its applications to pharmacy, arts and manufactures. Chemical news office. 1875: 294– [27 February 2011]. (原始内容存档于2014-02-10).



