甲烷
| 甲烷 | |||
|---|---|---|---|
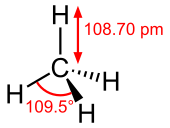
| |||
| |||
| IUPAC名 Methane[1][2] | |||
| 系統名 Carbane 碳烷(從不推薦[1]) | |||
| 別名 |
| ||
| 識別 | |||
| CAS號 | 74-82-8 | ||
| PubChem | 297 | ||
| ChemSpider | 291 | ||
| SMILES |
| ||
| Beilstein | 1718732 | ||
| Gmelin | 59 | ||
| 3DMet | B01450 | ||
| UN編號 | 1971 | ||
| EINECS | 200-812-7 | ||
| ChEBI | 16183 | ||
| RTECS | PA1490000 | ||
| KEGG | C01438 | ||
| MeSH | Methane | ||
| 性質 | |||
| 化學式 | CH4 | ||
| 摩爾質量 | 16.04 g·mol−1 | ||
| 外觀 | 無色氣體 | ||
| 氣味 | 無味 | ||
| 密度 | 0.697 g/L(氣態,27 °C,1.8 atm) 0.716 g/L(氣態,0 °C,1 atm) 0.42262 g cm−3 (液態,-186 °C)[3] | ||
| 熔點 | -182 °C(90.7 K) | ||
| 沸點 | -161 °C(111.66 K) | ||
| 溶解性(水) | 22.7 mg L−1 | ||
| 溶解性 | 溶於乙醇、乙醚、苯、甲苯、甲醇、丙酮 | ||
| log P | 1.09 | ||
| kH | 14 nmol Pa−1 kg−1 | ||
| 結構 | |||
| 分子構型 | 正四面體 | ||
| 偶極矩 | 0 D | ||
| 熱力學 | |||
| ΔfHm⦵298K | −74.87 kJ mol−1 | ||
| ΔcHm⦵ | −891.1 to −890.3 kJ mol−1 | ||
| S⦵298K | 186.25 J K−1 mol−1 | ||
| 熱容 | 35.69 J K−1 mol−1 | ||
| 危險性 | |||
| 警示術語 | R:R12 | ||
| 安全術語 | S:S2, S16, S33 | ||
| 歐盟分類 | |||
GHS危險性符號
| |||
| GHS提示詞 | DANGER | ||
| H-術語 | H220 | ||
| P-術語 | P210 | ||
| NFPA 704 | |||
| 爆炸極限 | 4.4–17% | ||
| 相關物質 | |||
| 相關化合物 | |||
| 相關物質 | |||
| 相關烷烴、氫化物 | 乙烷、丙烷、甲硅烷、甲鍺烷、甲錫烷、鉛烷 | ||
| 相關化學品 | 甲醇、一氯甲烷、甲酸、甲醛 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
甲烷(英語:Methane),是結構最簡單的烴類,化學式為CH
4,由一個碳原子以及四個氫原子組成。它是天然氣的主要成分。甲烷在地球上有很高的相對豐度,使之成為很有發展潛力的一種燃料,但在標準狀態下收集以及存儲氣態的甲烷是一個十分有挑戰性的課題。
在自然狀態下,甲烷可以在地底下或者海底找到,大氣中也含有甲烷,這些甲烷稱為大氣甲烷[5]。在原始大氣中,甲烷是主要成分之一。自1750年以來,地球大氣中的甲烷濃度增加了約150%,造成的全球暖化效應以及全球所有溫室氣體的20%(不包括水蒸氣)[6]。在太空中,不少星體的表面和大氣中也有甲烷。
甲烷的結構是由一個碳和四個氫原子透過sp3混成的方式化合而成,而且是所有烴類物質中,含碳量最小,且含氫量最大的碳氫化合物,因此甲烷分子的分子結構是一個正四面體的結構,碳大約位於該正四面體的幾何中心,氫位於其四個頂點,且四個碳氫鍵的鍵的鍵角相等、鍵長等長。標準狀態下的甲烷是一種無色無味的氣體[7]。一些有機物在缺氧情況下分解時所產生的沼氣主要成分就是甲烷。
歷史
[編輯]1776年11月,意大利物理學家亞歷山卓·伏打(Alessandro Volta, 1745年2月18日-1827年3月5日)根據本傑明·富蘭克林(Benjamin Franklin 1706年1月17日-1790年4月17日)關於「可燃空氣」的論文,在瑞士的馬焦雷湖(Lago Maggiore)中發現了甲烷[8]。伏打在沼澤中收集冒出來的甲烷,直到1778年成功分離出純的甲烷氣體[9],他還利用電火花裝置成功點燃甲烷氣體確定了甲烷的可燃性[9]。
分子性質
[編輯]甲烷分子是一種正四面體分子,有四個等價的碳氫鍵。其分子結構是由碳跟氫的價軌域重疊所形成的分子軌域構成,最低能量的分子軌域為的2s軌域上的碳與同相組合的1s軌域上的四個氫原子重疊的結果,而能量稍微高一點的由三個分子軌域重疊的結果,即氫原子的一個s軌域電子和三個碳原子的p軌域電子重疊形成一個σ軌域,更精確的說法是,發生混成而形成了sp3混成軌域。這種化合方式與實際觀測到的甲烷光譜吻合。
常溫常壓下的甲烷是一種無色無味的氣體[7]。家用天然氣的特殊味道,是為了安全而添加的人工氣味,通常是使用甲硫醇或乙硫醇。在一大氣壓力的環境中,甲烷的沸點是−161 °C[10]。甲烷是一種十分容易閃燃甚至會爆炸的氣體,只要空氣中甲烷含量在4.4-17%的範圍內就很容易起火或爆炸。
目前已知有九種不同的固態甲烷晶體結構[11]。若在常壓下將甲烷降至甲烷的冰點會形成甲烷一(英語:methane I)的晶體結構,這種晶體結構屬於立方晶系,空間群為Fm3m。由於氫原子的位置在甲烷一晶格中是不固定的,即甲烷分子可以自由轉動。因此,它是一個可塑性晶體[12]。
甲烷是天然氣的主要成分,約佔了87%,液化的甲烷不會燃燒,除非在高壓的環境中(通常是4~5大氣壓力)。
可能對健康造成的影響
[編輯]甲烷並非毒氣;然而,其具有高度的易燃性,和空氣混合時也可能造成爆炸。甲烷和氧化劑、鹵素或部份含鹵素之化合物接觸會有極為猛烈的反應。甲烷同時也是一種窒息氣體,在密閉空間內可能會取代氧氣。若氧氣被甲烷取代後含量低於19.5%時可能導致窒息。當有建築物位於垃圾掩埋場附近時,甲烷可能會滲透入建築物內部,讓建物內的居民暴露在高含量的甲烷之中。某些建築物在地下室設有特別的回復系統,會主動捕捉甲烷,並將之排出至建築物外。
來源
[編輯]甲烷是天然氣的最主要成分,是很重要的燃料;同時也是溫室氣體:其全球變暖潛能為21(即它的暖化能力比二氧化碳高二十一倍)。主要來源有:
製取
[編輯]- CH3COONa + NaOH → CH4↑ + Na2CO3
化學反應
[編輯]甲烷主要化學反應是:燃燒、蒸汽重整合成氣、以及鹵化反應。在一般情況下,甲烷的反應是很難控制。甲烷可以氧化成甲醇,但一般來說要完成這個化學反應時十分困難的,因為在一般情況下甲烷的氧化反應產物通常是二氧化碳與水,即使氧氣不足也很難產生甲醇。但是若在酵素的協助下就能輕易地完成此氧化反應,例如甲烷單加氧酶,但產量無法達到工業生產的規模[14]。
反應性
[編輯]由於甲烷中碳原子與氫原子間的化學鍵為較穩定的σ鍵,化學性質比較穩定,因此甲烷能參與的反應較其他有機物少。
燃燒
[編輯]甲烷的燃燒熱約為 55.5 MJ/kg [15]。燃燒時產生明亮的藍色火焰。甲烷的燃燒是一個多步反應。下面的反應式是過程的一部分,與所述淨結果是: CH4 + 2 O2 → CO2 + 2 H2O (ΔH = −891 k J/mol)
- CH4+ M* → CH3 + H + M
- CH4 + O2 → CH3 + H2O
- CH4 + HO2 → CH3 + 2 OH
- CH4 + OH → CH3 + H2O
- O2 + H → O + OH
- CH4 + O → CH3 + OH
- CH3 + O2 → CH2O + OH
- CH2O + O → CHO + OH
- CH2O + OH → CHO + H2O
- CH2O + H → CHO + H2
- CHO + O → CO + OH
- CHO + OH → CO + H2O
- CHO + H → CO + H2
- H2 + O → H + OH
- H2 + OH → H + H2O
- CO + OH → CO2 + H
- H + OH + M → H2O + M*
- H + H + M → H2 + M*
- H + O2 + M → HO2 + M*
加熱分解
[編輯]在隔絕空氣的條件下加熱到將近1000℃,就開始分解;加熱時間較長,到1500℃左右,分解接近完全。
當甲烷與氯在黑暗中混合時,兩者不會產生化學反應,如果把混合物加熱或以紫外光照射,以下反應(取代反應)會發生:[16]
- CH4 + Cl2 → CH3Cl + HCl
- CH3Cl + Cl2 → CH2Cl2 + HCl
- CH2Cl2 + Cl2 → CHCl3 + HCl
- CHCl3 + Cl2 → CCl4 + HCl
反應的機理屬於自由基取代,有鍵引發、鍵增長、鍵中止三步驟。
反應的產物含有此四種氯化甲烷,由上至下四種產物名稱分別為:一氯甲烷,二氯甲烷,三氯甲烷,四氯甲烷(四氯化碳),四者的比例視甲烷與氯的比例。 甲烷可與溴產生類似反應。甲烷與氟的反應十分猛烈,如果先用稀有氣體稀釋兩者才在特定的儀器內進行反應,也可得出類似反應。甲烷與碘不會直接產生反應,可以用溴化碘等代替進行碘化。
參見
[編輯]參考文獻
[編輯]- ^ 1.0 1.1 Front Matter. Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014: 3–4. ISBN 978-0-85404-182-4. doi:10.1039/9781849733069-FP001.
Methane is a retained name (see P-12.3) that is preferred to the systematic name 『carbane’, a name never recommended to replace methane, but used to derive the names 『carbene’ and 『carbyne’ for the radicals H2C2• and HC3•, respectively.
- ^ methane (CHEBI:16183). Chemical Entities of Biological Interest. UK: European Bioinformatics Institute. 2009-10-17 [2011-10-10]. (原始內容存檔於2018-12-26).
- ^ Gas Encyclopedia. [2013-11-07]. (原始內容存檔於2018-12-26).
- ^ NOAA Office of Response and Restoration, US GOV. METHANE. noaa.gov. [2016-01-28]. (原始內容存檔於2019-01-09).
- ^ Khalil, M. A. K. Non-Co2 Greenhouse Gases in the Atmosphere. Annual Review of Energy and the Environment. 1999, 24: 645. doi:10.1146/annurev.energy.24.1.645.
- ^ Technical summary. Climate Change 2001. United Nations Environment Programme. [2016-01-28]. (原始內容存檔於2011-06-04).
- ^ 7.0 7.1 Hensher, David A. and Button, Kenneth J. Handbook of transport and the environment. Emerald Group Publishing. 2003: 168 [2014-09-14]. ISBN 0-08-044103-3. (原始內容存檔於2014-09-21).
- ^ Volta, Alessandro (1777) Lettere del Signor Don Alessandro Volta … Sull' Aria Inflammabile Nativa delle Paludi [Letters of Signor Don Alessandro Volta … on the flammable native air of the marshes], Milan, Italy: Giuseppe Marelli.
- ^ 9.0 9.1 Methane. BookRags. [2012-01-26]. (原始內容存檔於2016-03-03).
- ^ Methane Phase change data (頁面存檔備份,存於網際網路檔案館). NIST Chemistry Webbook.
- ^ Bini, R.; Pratesi, G. High-pressure infrared study of solid methane: Phase diagram up to 30 GPa. Physical Review B. 1997, 55 (22): 14800–14809. doi:10.1103/physrevb.55.14800.
- ^ Kristallgitter. paarpraxis-rheinmain.de. 2015-02-26 [2016-01-28]. (原始內容存檔於2016-03-04).
- ^ Miller, G. Tyler (2007). Sustaining the Earth: An Integrated Approach. U.S.A.: Thomson Advantage Books, ISBN 978-0-534-49672-2, p. 160.
- ^ Baik, Mu-Hyun; Newcomb, Martin; Friesner, Richard A.; Lippard, Stephen J. Mechanistic Studies on the Hydroxylation of Methane by Methane Monooxygenase. Chemical Reviews. 2003, 103 (6): 2385–419. PMID 12797835. doi:10.1021/cr950244f.
- ^ Energy Content of some Combustibles (in MJ/kg) (頁面存檔備份,存於網際網路檔案館). People.hofstra.edu. Retrieved on March 30, 2014.
- ^ March, Jerry. Advance Organic Chemistry: Reactions, Mechanisms and Structure. New York: McGraw-Hill Book Company. 1968: 533–534.



