血紅蛋白
此條目需要擴充。 (2010年9月12日) |




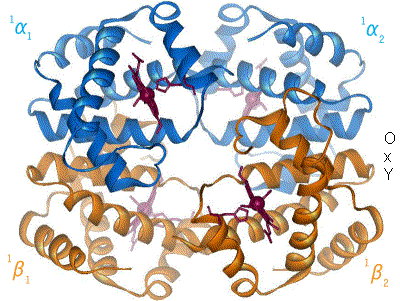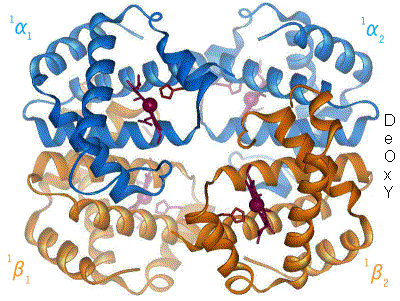
血紅素[註 1](Hemoglobin,縮寫 Hb、Hgb)又稱血紅蛋白,俗稱血色素,是高等生物體內紅色含鐵的攜氧結合蛋白。血紅蛋白的結構為異源四聚體,由2對珠蛋白組成,每個珠蛋白結合1個血紅素。
哺乳動物的一個血紅蛋白分子,可以結合最多四個氧分子。可以用平均細胞血紅蛋白濃度測出濃度。

分佈與分類
[編輯]血紅蛋白和類血紅蛋白分子存在於幾乎所有的脊椎動物體內,在許多無脊椎動物、真菌和植物中也有分佈。在這些機體中,血紅蛋白可能攜帶氧氣,抑或扮演轉移和調節二氧化碳、一氧化氮、硫化氫和硫化物的角色。其中一種稱作豆血紅蛋白(Leghemoglobin)的變體分子是用來清除氧氣以免毒害諸如豆科植物的固氮根瘤的厭氧系統的。
哺乳動物中血紅蛋白占紅細胞乾重的97%、總重的35%。人類血紅蛋白由2對(4條)血紅蛋白單體聚合成四聚體,每個血紅蛋白單體由每一條肽鏈和一個血紅素連接構成。肽鏈有兩種(即珠蛋白的兩種肽鏈):含141個氨基酸殘基的α鏈和含146個氨基酸殘基的非α鏈(β、γ及δ鏈,各種都有固定的氨基酸排列順序)。其中α鏈基因位於16號染色體,β、δ、γ鏈基因位於11號染色體。
血紅蛋白有多種類型,正常人出生後有三種血紅蛋白:
- 血紅蛋白A(HbA):占成人血紅蛋白的96%-98%,由一對α鏈和一對β鏈組成(α2β2);
- 血紅蛋白A2(HbA2):由一對α鏈和一對δ鏈組成(α2δ2),占血紅蛋白的2%~3%;
- 胎兒血紅蛋白(HbF):由一對α鏈和一對γ鏈組成(α2γ2),僅存在於胎兒血中,出生6個月後含量僅1%左右。
此外還有:血紅蛋白H(HbH),由四個相同β鏈組成的血紅蛋白(β4);血紅蛋白C(HbC),β鏈中Lys被Glu取代的血紅蛋白;血紅蛋白S(HbS),鐮刀狀細胞紅蛋白;血紅蛋白O2(HbO2,HHbO2),氧合血紅蛋白;血紅蛋白CO(HbCO),一氧化碳結合血紅蛋白。
生化特性
[編輯]血紅蛋白化學式:C3032H4816O812N780S8Fe4,分子量約 64,000Da(64,458 g/mol)[1]。人體內的血紅蛋白由四個亞基構成(共含四條帶血紅素基團的多肽鏈),分別為兩個α亞基和兩個β亞基,在與人體環境相似的電解質溶液中血紅蛋白的四個亞基可以自動組裝成α2β2的形態。血液中的血紅蛋白從呼吸器官中將氧氣運輸到身體其他部位釋放,以滿足機體氧化營養物質支持功能運轉之需要,並將由此生成的二氧化碳帶回呼吸器官中以排出體外。平均每克血紅蛋白可結合1.34ml的氧氣,是血漿溶氧量的70倍。
血紅蛋白的每個亞基由一條肽鏈和一個血紅素分子構成,肽鏈在生理條件下會盤繞摺疊成球形,把血紅素分子抱在裏面,這條肽鏈盤繞成的球形結構又被稱為珠蛋白。血紅素分子是一個具有卟啉結構的小分子,在卟啉分子中心,由卟啉中四個吡咯環上的氮原子與一個亞鐵離子配位結合,珠蛋白肽鏈中第8位的一個組氨酸殘基中的咪唑側鏈上的氮原子從卟啉分子平面的上方與亞鐵離子配位結合,使中心離子鐵(II)成為五配位,既是配位中心,又是活性中心。當血紅蛋白不與氧結合的時候,有一個水分子從卟啉環下方與亞鐵離子配位結合,而當血紅蛋白載氧的時候,就由氧分子頂替水的位置。
血紅蛋白與氧的結合可受到2,3-二磷酸甘油酸(2,3-BPG)的調控,成人的血紅素組成為α2β2,使成人血紅蛋白對氧的親和性降低,而胎兒血紅蛋白的組成為α2γ2,不受2,3-二磷酸甘油酸影響。
血紅蛋白中鐵(II)能可逆地結合氧分子,取決於氧分壓。與氧結合時,血紅素中的二價鐵化學價不變,形成呈鮮紅色的氧合血紅蛋白,與氧解離後帶有淡藍色。與氧結合的具體過程非常神奇:沒有氧存在時,四個亞基間相互作用力很強;氧分子越多,與血紅蛋白結合力越強。首先一個O2與血紅蛋白四個亞基中的一個結合,與氧結合之後的珠蛋白結構發生變化,造成整個血紅蛋白結構的變化;這種變化使得第二個氧氣分子相比於第一個氧氣分子更容易尋找血紅蛋白的另一個亞基結合,而它的結合會進一步促進第三個氧氣分子的結合;以此類推,直到構成血紅蛋白的四個亞基分別與四個氧氣分子結合。而在組織內釋放氧的過程也是這樣,一個氧氣分子的離去會刺激另一個的離去,直到完全釋放所有的氧氣分子,這種有趣的現象稱為協同效應。

由於協同效應,血紅蛋白與氧氣的結合曲線呈S形,在特定範圍內隨着環境中氧含量的變化,血紅蛋白與氧分子的結合率有一個劇烈變化的過程,生物體內組織中的氧濃度和肺組織中的氧濃度恰好位於這一突變的兩側,因而在肺組織,血紅蛋白可以充分地從氧分壓較高的肺泡中攝取氧,並隨着血液循環把氧氣釋放到氧分壓較低的組織中,充分地釋放所攜帶的氧分子,從而起到輸氧作用;可是當環境中的氧氣含量很高或者很低的時候,血紅蛋白的氧結合曲線非常平緩。
除了運載氧,血紅蛋白還可以與硫化氫、一氧化碳、氰離子結合,結合的方式也與氧完全一樣,所不同的只是結合的牢固程度,一氧化碳、氰離子一旦和血紅蛋白結合就很難離開,即使濃度很低也能優先和血紅蛋白結合,致使通往組織的氧氣流中斷,這就是煤氣中毒和氰化物中毒的原理,使氧氣與血紅蛋白的結合能力下降,使人窒息而死亡。遇到這種情況可以使用其他與這些物質結合能力更強的物質來解毒,比如一氧化碳中毒可以用靜脈注射亞甲基藍的方法來救治。
血紅蛋白也參與其他氣體的轉運:它能攜帶機體的部分二氧化碳(大約10%)。亦可將重要的調節分子一氧化氮結合在球狀蛋白的某個硫醇基團上,在釋放氧氣的同時將其釋放。在紅細胞及其祖系細胞以外也發現了血紅蛋白——包括黑質中的A9多巴胺神經元、巨噬細胞、肺泡細胞以及腎臟中的繫膜細胞。在這些組織中,血紅蛋白作為抗氧化劑和鐵代謝的調節因子存在,適用於生物高溫攜氧,在低溫情況下攜氧效果低。


相關病症
[編輯]血紅蛋白病是一組遺傳性溶血性貧血,分為兩大類:珠蛋白肽鏈分子結構異常(如:鐮刀形細胞貧血症等)和珠蛋白肽鏈合成數量異常(地中海貧血)
- 正鐵血紅蛋白血症
- 鐮刀形細胞貧血症,在Hbs分子中,其β次單元的Glu6(側鏈帶負電)突變成Val6(側鏈疏水),以致結構變形。
- 地中海貧血症,分為兩種:甲型(α-Thalassemias)和乙型(β-Thalassemias)。甲型會形成β4或γ4,其α次單元有缺失,分為3類: ①靜止型或標準型α地中海貧血:如果4個α基因僅缺失1個,表現為靜止型;如缺失2個則為標準型;②血紅蛋白H(HbH或β4)病:4個α基因缺失3個;③血紅蛋白Bart胎兒水腫綜合症:父母雙方均為d地中海貧血,胎兒4個α基因全部缺失,α鏈絕對缺乏,γ鏈自相聚合成Hb Bart(γ4)。乙型患者β珠蛋白鏈的合成缺少,世界上至少1.5億人攜帶β珠蛋白基因缺陷(常染色體顯性遺傳)中的一種。患者相對增多的未結合α鏈自聚成不穩定的α聚合體,並在幼紅細胞內沉澱形成包涵體,引起膜的損害而致溶血。γ和δ鏈代償合成,致HbA2(α2δ2)和HbF(α2γ2)增多,HbF的氧親和力高,加重組織缺氧。
備註
[編輯]- ^ 英語 hemoglobin,中國大陸稱血红蛋白,臺灣稱血紅素;而英語 heme,中國大陸稱血红素,臺灣稱血基質。兩術語極易混淆,在閱讀漢語文獻時,應釐清討論對象。
參考文獻
[編輯]- ^ Van Beekvelt MC, Colier WN, Wevers RA, Van Engelen BG. Performance of near-infrared spectroscopy in measuring local O2 consumption and blood flow in skeletal muscle. J Appl Physiol. 2001, 90 (2): 511–19. PMID 11160049. S2CID 15468862. doi:10.1152/jappl.2001.90.2.511.
延伸閱讀
[編輯]| 關於血紅蛋白 的圖書館資源 |
- Campbell, MK. Biochemistry third. Harcourt. 1999. ISBN 0-03-024426-9.
- Eshaghian, S; Horwich, TB; Fonarow, GC. An unexpected inverse relationship between HbA1c levels and mortality in patients with diabetes and advanced systolic heart failure. Am Heart J. 2006, 151 (1): 91.e1–91.e6. PMID 16368297. doi:10.1016/j.ahj.2005.10.008.
- Ganong, WF. Review of Medical Physiology 21st. Lange. 2003. ISBN 0-07-140236-5.
- Hager, T. Force of Nature: The Life of Linus Pauling. Simon and Schuster. 1995. ISBN 0-684-80909-5.
- Kneipp J, Balakrishnan G, Chen R, Shen TJ, Sahu SC, Ho NT, Giovannelli JL, Simplaceanu V, Ho C, Spiro T. Dynamics of allostery in hemoglobin: roles of the penultimate tyrosine H bonds. J Mol Biol. 2005, 356 (2): 335–53. PMID 16368110. doi:10.1016/j.jmb.2005.11.006.
