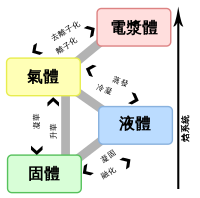
熔點

熔點(凝固點)(M.P.)是在大氣壓下晶體將其物態由固態轉變為液態的過程中固液共存狀態的溫度;各種晶體的熔點不同,對同一種晶體,熔點又與所受壓力有關,壓強越大,熔點越高。物質的熔點取決於壓力,通常在1個大氣壓或100 kPa等標準壓力下指定。不過,與沸點不同,熔點受壓強的影響很小,因爲由固態轉變(熔化)為液態的過程中,物質的體積幾乎不變化。
進行相反動作(即由液態轉為固態)的溫度,稱之為凝固點、結晶點(對水而言也稱為冰點),在一定大氣壓下,任何晶體的凝固點和熔點相同。習慣上,根據常溫(25℃)時物質的狀態使用凝固點或熔點稱呼這一個溫度:對於常溫下為固態的物質,這個溫度稱爲凝固點;對於常溫下為液態的物質,這個溫度稱爲熔點。
因為物質可能會過冷,可能會在溫度低於凝固點時才凝固。可以確認物質的「特徵凝固點」,而實際量測熔點的方式是觀察到物質如何開始變成液態,該溫度即為熔點[1]。
一般的,非晶體並沒有固定的熔點和凝固點。
例子
[編輯]
大部份物質的熔點和凝固點是一樣的。例如汞的熔點和凝固點都是234.32 K(−38.83 °C;−37.89 °F)[2]。不過有些物質的熔點和凝固點不同,例如洋菜熔點是85 °C(185 °F;358 K),凝固點是31 °C(88 °F;304 K),這種差異稱為遲滯現象。冰在一大氣壓下力下的熔點很接近[3]0 °C(32 °F;273 K),這也稱為冰點。但因為成核物質的影響,水的熔點和凝固點不一定相同。若沒有成核物質,水可以過冷到−48.3 °C(−54.9 °F;224.8 K)才結冰。
熔點最高的化學元素是鎢,熔點是3,414 °C(6,177 °F;3,687 K)[4],因此鎢適合用在白熾燈的燈絲上。碳在常壓下不會熔化,而是會在3,700 °C(6,700 °F;4,000 K)直接昇華,只有在壓力10 MPa(99 atm),溫度到4,030—4,430 °C(7,290—8,010 °F;4,300—4,700 K)時才會變液態。碳化鉭鉿(Ta4HfC5)是耐火材料,熔點可以到4,215 K(3,942 °C;7,127 °F)[5]。量子機械電腦的模擬預測合金HfN0.38C0.51的熔點更高(約4400 K)[6],是常壓下熔點最高的物質。此估計後來也經由實驗證實[7]。若考慮低凝固點的物質,氦在常壓下,就算溫度低到接近絕對零度也不會凝固,需要壓力超過20大氣壓才能使其凝固。
熱力學
[編輯]
固體要熔化,需要加熱使其溫度到達熔點。之後還要再繼續加熱才會熔化,使其熔化所加的熱是熔化熱,因為過程中溫度不變,屬於潛熱。
在壓力的大幅變化下,熔點也會變化,但熔點相對壓力的靈敏度比沸點要低,因為固態到液態的相變其體積變化不大[8][9]。大部份的情形下,固態的物質密度會比液態的要大,因此其熔點會因為壓力增加而上昇。否則,其熔點會因為壓力增加而下降。水就是後者著名的例子,在右圖中有相關的說明,而矽、鍺、鎵、鉍也有類似的特性。在特別大的壓力變化下,會看到熔點的顯著變化。例如,矽在常壓(0.1 MPa)下的熔點是1415 °C,但若壓力超過10 GPa,其熔點會降到1000 °C.[10]。
Carnelley法則
[編輯]有機化學中的Carnelley法則是由Thomas Carnelley在1882年提出的,其中提到「高分子對稱性和高熔點有關。」[11]Carnelley依其法則檢驗了一萬五千種化合物。例如化學式都是C5H12的三種結構異構物中,新戊烷的熔點最高,是−16.4 °C (256.8 K),再來是正戊烷的 −129.8 °C (143 K),最低的是異戊烷的 −160 °C (113 K) [12]。類似的情形出現在二甲苯和二氯苯,間異構物熔點最低,再來是鄰異構物,對異構物熔點最高。吡啶的對稱性比苯要低,因此其熔點也比較低,而二嗪熔點就比較高,三嗪熔點就更高。許多籠狀化合物(例如金剛烷及立方烷)有高對稱性,其熔點也很高。
高熔點對應高熔化熱,低熔化熵。高度對稱的分子,其晶相緊密,有許多的分子間作用力,因此熔化的焓變比較大。

預測物質的熔點(林德曼準則)
[編輯]弗雷德里克·林德曼在1910年就想要預測晶體物質的熔點,是最早有此想法的人[14]。其理論背後的概念是觀察在溫度上昇時,熱振動的平均振幅也會上昇。當振幅大到鄰近原子開始要佔據同一個空間時,熔化就開始了。林德曼準則認為當振動均方根振幅超過一定值時,就開始熔化了。
假設在晶體中的所有原子都以相同的頻率ν振動,其平均熱能可以用能量均分定理估計[15]
其中m是原子量,ν是頻率,u是平均振動振幅,kB是波茲曼常數,T是熱力學溫度。若u2的閾值是c2a2,其中c是林德曼因子,而a是原子間距,熔點估計是
依照平均熱能的估計方式不同,也有許多其他的估計公式。另一個常用的公式是[16]
從德拜模型ν的表示式,可以得到
其中θD是德拜溫度,h是普朗克常數。針對大部份的材料,c的值範圍從0.15到0.3[17]。
熔點預測
[編輯]阿法埃莎在2011年2月在釋放了超過一萬個其型錄上物質的熔點作為開放資料。此資料集可以創建熔點預測的隨機森林模型,而且可以免費取得[18]。在《Nature Precedings》中也可以取得開放的熔點資料[19]。Tetko等人從專利中找到高品質的資料[20],以該資料的模型也已發表[21]。
參考文獻
[編輯]- ^ Ramsay, J. A. A New Method of Freezing-Point Determination for Small Quantities. Journal of Experimental Biology. 1 May 1949, 26 (1): 57–64. PMID 15406812. doi:10.1242/jeb.26.1.57.[失效連結]
- ^ Haynes, p. 4.122.
- ^ 純水的熔點是0.002519 ± 0.000002 °C,參考Feistel, R.; Wagner, W. A New Equation of State for H2O Ice Ih. J. Phys. Chem. Ref. Data. 2006, 35 (2): 1021–1047. Bibcode:2006JPCRD..35.1021F. doi:10.1063/1.2183324.
- ^ Haynes, p. 4.123.
- ^ Agte, C.; Alterthum, H. Researches on Systems with Carbides at High Melting Point and Contributions to the Problem of Carbon Fusion. Z. Tech. Phys. 1930, 11: 182–191.
- ^ Hong, Q.-J.; van de Walle, A. Prediction of the material with highest known melting point from ab initio molecular dynamics calculations. Phys. Rev. B. 2015, 92 (2): 020104(R). Bibcode:2015PhRvB..92b0104H. doi:10.1103/PhysRevB.92.020104
 .
.
- ^ Buinevich, V.S.; Nepapushev, A.A.; Moskovskikh, D.O.; Trusov, G.V.; Kuskov, K.V.; Vadchenko, S.G.; Rogachev, A.S.; Mukasyan, A.S. Fabrication of ultra-high-temperature nonstoichiometric hafnium carbonitride via combustion synthesis and spark plasma sintering. Ceramics International. March 2020, 46 (10): 16068–16073. doi:10.1016/j.ceramint.2020.03.158.
- ^ 兩者的關係可以用克勞修斯-克拉佩龍方程式表示
- ^ J10 Heat: Change of aggregate state of substances through change of heat content: Change of aggregate state of substances and the equation of Clapeyron-Clausius. [19 February 2008]. (原始內容存檔於2021-05-08).
- ^ Tonkov, E. Yu. and Ponyatovsky, E. G. (2005) Phase Transformations of Elements Under High Pressure, CRC Press, Boca Raton, p. 98 ISBN 0-8493-3367-9
- ^ Brown, R. J. C.; R. F. C. Melting Point and Molecular Symmetry. Journal of Chemical Education. 2000, 77 (6): 724. Bibcode:2000JChEd..77..724B. doi:10.1021/ed077p724.
- ^ Haynes, pp. 6.153–155.
- ^ Gilman, H.; Smith, C. L. Tetrakis(trimethylsilyl)silane. Journal of Organometallic Chemistry. 1967, 8 (2): 245–253. doi:10.1016/S0022-328X(00)91037-4.
- ^ Lindemann FA. The calculation of molecular vibration frequencies. Phys. Z. 1910, 11: 609–612.
- ^ Sorkin, S., (2003), Point defects, lattice structure, and melting (頁面存檔備份,存於網際網路檔案館), Thesis, Technion, Israel.
- ^ Philip Hofmann. Solid state physics: an introduction. Wiley-VCH. 2008: 67 [13 March 2011]. ISBN 978-3-527-40861-0. (原始內容存檔於2015-03-21).
- ^ Nelson, D. R., (2002), Defects and geometry in condensed matter physics (頁面存檔備份,存於網際網路檔案館), Cambridge University Press, ISBN 0-521-00400-4
- ^ Predict melting point from SMILES (頁面存檔備份,存於網際網路檔案館). Qsardb.org. Retrieved on 13 September 2013.
- ^ Bradley, Jean-Claude; Lang, Andrew; Williams, Antony; Curtin, Evan. ONS Open Melting Point Collection. Nature Precedings. 11 August 2011. doi:10.1038/npre.2011.6229.1
 .
.
- ^ OCHEM melting point models[失效連結]. ochem.eu. Retrieved on 18 June 2016.
- ^ Tetko, Igor V; m. Lowe, Daniel; Williams, Antony J. The development of models to predict melting and pyrolysis point data associated with several hundred thousand compounds mined from PATENTS. Journal of Cheminformatics. 2016, 8: 2. PMC 4724158
 . PMID 26807157. doi:10.1186/s13321-016-0113-y.
. PMID 26807157. doi:10.1186/s13321-016-0113-y.