细胞信号传送
在生物学中,细胞信号传送[1](英語:cell signaling)又称細胞訊息傳導、細胞傳訊[2],是指细胞与自身、其他细胞及环境相互作用的过程。细胞信号传送是所有原核生物和真核生物细胞生命的基本特性。 通常,信号传送过程涉及三个组成部分:信号、受体和效应器(動器)。
在生物学中,信号大多是化学性质的,但也可以是压力、电压、温度或光等物理线索。化学信号是能够结合并激活特定受体的分子。这些分子,也称为配体,具有化学多样性,包括离子、脂质(例如类固醇、前列腺素)、肽类(例如胰岛素、ACTH)、碳水化合物、糖基化蛋白质(蛋白多糖)、核酸等。肽类和脂质配体尤为重要,因为大多数激素属于这些化学物质类别。肽通常是极性的、亲水性分子。因此,它们无法自由扩散穿过质膜的双脂层,所以它们的作用是通过细胞膜上的受体介导的。另一方面,亲脂性化学物质,如类固醇激素,可以被动地扩散穿过质膜并与细胞内受体相互作用。细胞信号可以在短距离或长距离发生,并且可以进一步分类为自分泌、内分泌、旁分泌、旁分泌或内分泌。自分泌信号传送发生在产生信号化学物的同一细胞上。[3]内分泌信号传送发生在细胞产生的化学信号作用于同一细胞的细胞质或细胞核内的受体上。[4]旁分泌信号传送发生在物理上相邻的细胞之间。[5]旁分泌信号传送发生在相邻的细胞之间。内分泌作用发生在远距离的细胞之间,化学信号通常由血液携带。[6]
受体是复杂的蛋白质或紧密结合的蛋白质多聚体,位于质膜或细胞内部,如细胞质、细胞器和细胞核。受体具有通过结合特定化学物或与物理因子相互作用时发生构象变化来检测信号的能力。特定配体与其受体之间的化学相互作用的特异性,赋予了触发特定细胞反应的能力。受体可以广泛分类为细胞膜受体和细胞内受体。
细胞膜受体可以进一步分类为离子通道联接受体、G蛋白偶联受体和酶联接受体。
离子通道受体是具有配体激活门功能的大型跨膜蛋白。当这些受体被激活时,它们可能允许或阻止特定离子穿过细胞膜。大多数由压力或温度等物理刺激激活的受体属于这一类别。
G蛋白受体是嵌入质膜中的多聚蛋白。这些受体具有细胞外、跨膜和细胞内域。细胞外域负责与特定配体的相互作用。细胞内域负责启动一系列化学反应的级联,最终触发受体控制的特定细胞功能。 酶联接受体是具有细胞外结合特定配体的域和细胞内具有酶活性或催化活性的域的跨膜蛋白。激活后,酶部分负责促进特定的细胞内化学反应。
细胞内受体的作用机制不同。它们通常结合能够被动扩散穿过质膜的亲脂性配体,如类固醇激素。这些配体结合到特定的细胞质转运蛋白上,将激素-转运蛋白复合物运送到细胞核内,激活特定基因,促进特定蛋白质的合成。
信号传送途径的效应器组成部分始于信号转导。在这个过程中,信号通过与受体的相互作用,启动细胞内一系列分子事件,导致信号传送过程的最终效果。通常,最终效果包括激活离子通道(配体门控离子通道)或启动第二信使系统级联,将信号在细胞内传播。第二信使系统可以放大或调节信号,其中少量受体的激活会导致多个次级信使被激活,从而放大初始信号(第一信使)。这些信号通路的下游效应可能包括额外的酶活性,如蛋白水解切割、磷酸化、甲基化和泛素化。
信号分子可以通过各种生物合成途径合成,并通过被动或主动运输释放,甚至通过细胞损伤释放。
每个细胞都被编程来响应特定的细胞外信号分子,这是发育、组织修复、免疫和稳态的基础。信号传送相互作用中的错误可能导致癌症、自身免疫性疾病和糖尿病等疾病。
细胞外信号
[编辑]合成与释放
[编辑]
许多细胞信号由一个细胞释放并移动到另一个细胞与之接触的分子承载。信号分子可以属于几种化学类别:脂质、磷脂、氨基酸、单胺、蛋白质、糖蛋白或气体。与表面受体结合的信号分子通常是大分子且亲水性的(例如促甲状腺激素、抗利尿激素、乙酰胆碱),而进入细胞的信号分子通常是小分子且疏水性的(例如糖皮质激素、甲状腺激素、胆钙化醇、维甲酸),但两者都有重要的例外,同一分子可以通过表面受体或以内分泌方式作用产生不同的效果。在动物细胞中,专门的细胞释放这些激素并通过循环系统将它们发送到身体的其他部分。然后它们到达目标细胞,这些细胞可以识别并响应激素并产生结果。这也被称为内分泌信号传送。植物生长调节剂或植物激素通过细胞内移动或通过气体扩散到空气中以到达它们的目标。硫化氢由人体的某些细胞以少量产生,并具有许多生物信号功能。目前只有另外两种气体被知道在人体中作为信号分子:一氧化氮和一氧化碳。[7]
胞吐
[编辑]胞吐是指细胞将分子如神经递质和蛋白质运输出细胞的过程。作为一种主动运输机制,胞吐需要使用能量来运输物质。胞吐及其对应过程胞吞,后者是将物质带入细胞的过程,被所有细胞所使用,因为对它们来说大多数化学物质是大型极性分子,无法通过细胞膜的疏水性部分进行被动运输。胞吐是大量分子被释放的过程,因此是一种批量运输的形式。胞吐通过细胞质膜上称为胞口体的分泌门进行。胞口体是细胞质膜上永久性的杯状脂蛋白结构,在这里分泌囊泡暂时对接并融合,以将囊泡内的内容物从细胞中释放。[來源請求]
在胞吐过程中,膜结合的分泌囊泡被运送到细胞膜,在那里它们在胞口体处对接并融合,其内容物(即水溶性分子)被分泌到细胞外环境中。这种分泌是可能的,因为囊泡与质膜暂时性地融合。在神经传导的背景下,神经递质通常通过胞吐从突触囊泡释放到突触间隙中;然而,神经递质也可以通过反向运输通过膜运输蛋白被释放。[來源請求]
细胞信号传送的形式
[编辑]自分泌
[编辑]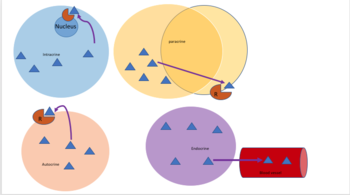
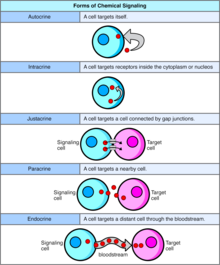
自分泌信号传送涉及细胞分泌激素或化学信使(称为自分泌剂),这些自分泌剂与同一细胞上的自分泌受体结合,导致该细胞自身的变化。[8] 这与旁分泌信号传送、内分泌信号传送或经典的内分泌信号传送形成对比。
内分泌
[编辑]在内分泌信号传送中,信号化学物质在细胞内产生并结合到细胞质或核受体上,而无需从细胞中分泌出来。在内分泌信号传送中,信号在不被分泌出细胞的情况下被传递。内分泌信号不被分泌到细胞外是内分泌信号传送与自分泌等其他细胞信号机制的区别。在自分泌和内分泌信号传送中,信号对产生它的细胞产生影响。[9]
近分泌
[编辑]旁分泌信号传送是多细胞生物中细胞与细胞或细胞与细胞外基质之间的信号传送类型,需要紧密接触。旁分泌信号传送有三种类型:
此外,在单细胞生物如细菌中,旁分泌信号传送意味着通过膜接触进行的相互作用。旁分泌信号传送已在一些生长因子、细胞因子和趋化因子细胞信号中观察到,它在免疫反应中发挥重要作用。通过直接膜接触的旁分泌信号传送也存在于神经元细胞体和小胶质细胞发育过程中及成年大脑的运动过程中。[10][11]
旁分泌
[编辑]在旁分泌信号传送中,一个细胞产生信号以诱导附近细胞的变化,改变这些细胞的行为。被称为旁分泌因子的信号分子在相对较短的距离上扩散(局部作用),与通过内分泌因子、激素(通过循环系统传播相当长的距离)的细胞信号传送;旁分泌相互作用;以及自分泌信号传送形成对比。产生旁分泌因子的细胞将它们分泌到直接的细胞外环境中。然后,因子传播到附近的细胞中,其中因子接收的梯度决定了结果。然而,旁分泌因子能够传播的确切距离尚不确定。
旁分泌信号如维甲酸只针对发出细胞附近的细胞。[12] 神经递质是旁分泌信号的另一个例子。
一些信号分子可以同时作为激素和神经递质。例如,肾上腺素和去甲肾上腺素在从肾上腺释放并通过血液传输到心脏时可以作为激素。去甲肾上腺素也可以由神经元产生,在大脑内作为神经递质。[13] 雌激素可以由卵巢释放,作为激素或通过旁分泌或自分泌信号在局部作用。[14]
尽管旁分泌信号传送在诱导的细胞中引发多样化的反应,但大多数旁分泌因子使用一套相对简化的受体和途径。实际上,身体中的不同器官 - 即使在不同物种之间 - 都已知在差异性发育中使用一套类似的旁分泌因子。[15] 这些高度保守的受体和途径可以基于相似结构分为四个主要家族:成纤维细胞生长因子(FGF)家族,刺猬家族,Wnt家族,和TGF-β超家族。旁分泌因子与其相应受体的结合启动信号转导级联,引发不同的反应。
计算模型
[编辑]用系统生物学的方法可以更好地帮助我们去理解参与信号通路之间交流的那些组成成分、复杂的配体和受体之间的结合以及动态的信号网络[16]。计算模型通常会将发表了文章中报道的某些信号通路中的元件之间的相互作用整合起来,然后将不同的元件聚到一个大类中,并描述这些元件之间存在的相互作用[17]。计算模型的发展能够让我们从全局,更加深入地探究细胞内的信号通路,比如操纵不同的变量和系统地对响应的结果进行评估[18]。 使用分析模型来学习信号转导已经被广泛地应用到了药物学、新药的发现(评估配体和受体间的相互作用)、药物代谢动力学以及代谢产物在大尺度网络下的流动。目前被广泛应用于细胞内信号通路建模的策略是使用常微分方程(ordinary differential equation, ODE)进行建模,比如,在时间尺度上,用公式来表示某一个信号分子的浓度是信号通路内上游或者(和)下游其他的分子的函数。常微分方程模型也已经被广泛地应用于分裂素激活的蛋白激酶、雌激素受体𝛂和mTOR等信号通路的动力学研究。 [19][20][21]。
参考文献
[编辑]- ^ 存档副本. [2023-12-24]. (原始内容存档于2023-12-24).
- ^ 存档副本. [2023-12-24]. (原始内容存档于2023-12-24).
- ^ Pandit, Nita K. Introduction to the pharmaceutical sciences 1st. Baltimore, Md.: Lippincott Williams & Wilkins. 2007. ISBN 978-0-7817-4478-2.
- ^ Re, Richard N. The intracrine hypothesis and intracellular peptide hormone action. BioEssays. April 2003, 25 (4): 401–409 [2023-12-03]. ISSN 0265-9247. doi:10.1002/bies.10248. (原始内容存档于2023-12-15) (英语).
- ^ Gilbert, Scott F.; Tyler, Mary S.; Kozlowski, Ronald N. Developmental biology 6th. Sunderland, Mass: Sinauer Assoc. 2000. ISBN 978-0-87893-243-6.
- ^ Hormones. medlineplus.gov. [2023-11-28]. (原始内容存档于2011-11-15).
- ^ Cooper GM, Hausman RE. Signaling Molecules and Their Receptors. NCBI bookshelf (编). The cell: a molecular approach 2nd. Washington, D.C.: ASM Press. 2000 [2023-12-03]. ISBN 978-0878933006. (原始内容存档于2022-10-21).
- ^ Pandit, Nikita K. Introduction To The Pharmaceutical Sciences. 2007: 238. ISBN 978-0-7817-4478-2.
- ^ Rubinow, Katya B. An intracrine view of sex steroids, immunity, and metabolic regulation. Molecular Metabolism. 2018-03-08, 15: 92–103 [2023-12-03]. ISSN 2212-8778. PMC 6066741
 . PMID 29551633. doi:10.1016/j.molmet.2018.03.001. (原始内容存档于2023-12-11).
. PMID 29551633. doi:10.1016/j.molmet.2018.03.001. (原始内容存档于2023-12-11).
- ^ Cserép, Csaba; Schwarcz, Anett D.; Pósfai, Balázs; László, Zsófia I.; Kellermayer, Anna; Környei, Zsuzsanna; Kisfali, Máté; Nyerges, Miklós; Lele, Zsolt; Katona, István. Microglial control of neuronal development via somatic purinergic junctions. Cell Reports. September 2022, 40 (12): 111369. PMC 9513806
 . PMID 36130488. doi:10.1016/j.celrep.2022.111369.
. PMID 36130488. doi:10.1016/j.celrep.2022.111369.
- ^ Cserép, Csaba; Pósfai, Balázs; Lénárt, Nikolett; Fekete, Rebeka; László, Zsófia I.; Lele, Zsolt; Orsolits, Barbara; Molnár, Gábor; Heindl, Steffanie; Schwarcz, Anett D.; Ujvári, Katinka; Környei, Zsuzsanna; Tóth, Krisztina; Szabadits, Eszter; Sperlágh, Beáta; Baranyi, Mária; Csiba, László; Hortobágyi, Tibor; Maglóczky, Zsófia; Martinecz, Bernadett; Szabó, Gábor; Erdélyi, Ferenc; Szipőcs, Róbert; Tamkun, Michael M.; Gesierich, Benno; Duering, Marco; Katona, István; Liesz, Arthur; Tamás, Gábor; Dénes, Ádám. Microglia monitor and protect neuronal function through specialized somatic purinergic junctions. Science. 31 January 2020, 367 (6477): 528–537 [2023-12-03]. Bibcode:2020Sci...367..528C. PMID 31831638. S2CID 209343260. doi:10.1126/science.aax6752. (原始内容存档于2023-05-02).
- ^ Duester G. Retinoic acid synthesis and signaling during early organogenesis. Cell. September 2008, 134 (6): 921–31. PMC 2632951
 . PMID 18805086. doi:10.1016/j.cell.2008.09.002.
. PMID 18805086. doi:10.1016/j.cell.2008.09.002.
- ^ Cartford MC, Samec A, Fister M, Bickford PC. Cerebellar norepinephrine modulates learning of delay classical eyeblink conditioning: evidence for post-synaptic signaling via PKA. Learning & Memory. 2004, 11 (6): 732–7. PMC 534701
 . PMID 15537737. doi:10.1101/lm.83104.
. PMID 15537737. doi:10.1101/lm.83104.
- ^ Jesmin S, Mowa CN, Sakuma I, Matsuda N, Togashi H, Yoshioka M, Hattori Y, Kitabatake A. Aromatase is abundantly expressed by neonatal rat penis but downregulated in adulthood. Journal of Molecular Endocrinology. October 2004, 33 (2): 343–59. PMID 15525594. doi:10.1677/jme.1.01548
 .
.
- ^ Paracrine Factors. [27 July 2018]. (原始内容存档于2023-05-25).
- ^ Chen, Raymond E.; Thorner, Jeremy. Systems biology approaches in cell signaling research. Genome Biology. 2005, 6 (10): 235 [2019-01-10]. ISSN 1474-760X. PMC 1257459
 . PMID 16207364. doi:10.1186/gb-2005-6-10-235. (原始内容存档于2019-01-10).
. PMID 16207364. doi:10.1186/gb-2005-6-10-235. (原始内容存档于2019-01-10).
- ^ Hughey, Jacob J; Lee, Timothy K; Covert, Markus W. Computational Modeling of Mammalian Signaling Networks. Wiley interdisciplinary reviews. Systems biology and medicine. 2010, 2 (2): 194–209 [2019-01-10]. ISSN 1939-5094. PMC 3105527
 . PMID 20836022. doi:10.1002/wsbm.52. (原始内容存档于2021-08-09).
. PMID 20836022. doi:10.1002/wsbm.52. (原始内容存档于2021-08-09).
- ^ Rangamani, Padmini; Iyengar, Ravi. Modelling cellular signalling systems. Essays in Biochemistry. 2008, 45: 83–94 [2019-01-10]. ISSN 0071-1365. PMC 3270941
 . PMID 18793125. doi:10.1042/BSE0450083. (原始内容存档于2021-08-09).
. PMID 18793125. doi:10.1042/BSE0450083. (原始内容存档于2021-08-09).
- ^ Kolch, Walter; Calder, Muffy; Gilbert, David. When kinases meet mathematics: the systems biology of MAPK signalling. FEBS letters. 2005-03-21, 579 (8): 1891–1895 [2019-01-10]. ISSN 0014-5793. PMID 15763569. doi:10.1016/j.febslet.2005.02.002. (原始内容存档于2019-01-10).
- ^ Tian, Dan; Solodin, Natalia M.; Rajbhandari, Prashant; Bjorklund, Kelsi; Alarid, Elaine T.; Kreeger, Pamela K. A kinetic model identifies phosphorylated estrogen receptor-α (ERα) as a critical regulator of ERα dynamics in breast cancer. FASEB journal: official publication of the Federation of American Societies for Experimental Biology. 2015-5, 29 (5): 2022–2031 [2019-01-10]. ISSN 1530-6860. PMC 4415015
 . PMID 25648997. doi:10.1096/fj.14-265637. (原始内容存档于2018-12-15).
. PMID 25648997. doi:10.1096/fj.14-265637. (原始内容存档于2018-12-15).
- ^ Sulaimanov, Nurgazy; Klose, Martin; Busch, Hauke; Boerries, Melanie. Understanding the mTOR signaling pathway via mathematical modeling. Wiley Interdisciplinary Reviews. Systems Biology and Medicine. 07 2017, 9 (4) [2019-01-10]. ISSN 1939-005X. PMC 5573916
 . PMID 28186392. doi:10.1002/wsbm.1379. (原始内容存档于2019-01-10).
. PMID 28186392. doi:10.1002/wsbm.1379. (原始内容存档于2019-01-10).
参见
[编辑]外部連結
[编辑]- Signaling Gateway Free summaries of recent research and the Molecule Pages database.
- Protein signaling domains (页面存档备份,存于互联网档案馆)
- NCI-Nature Pathway Interaction Database: authoritative information about signaling pathways in human cells.
- 醫學主題詞表(MeSH):Intercellular+Signaling+Peptides+and+Proteins
- 醫學主題詞表(MeSH):Cell+Communication
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
