铅化合物

铅化合物是含铅元素的化合物,在这些化合物中,铅主要呈现+2和+4价,其中+2价更稳定。无机的四价铅化合物是强氧化剂。[1]铅的含氧酸盐大都是无色或白色的,低价氧化物和碘化物有着鲜艳的颜色,二氧化铅和硫化铅都是黑色的固体。



铅化合物的化学性质
[编辑]多种铅化合物能够很容易地被还原为单质。如一氧化铅(PbO)在加热的时候可以被温和的有机还原剂(如葡萄糖)还原。一氧化铅和硫化铅共热,也能得到金属铅。[2]
- 2 PbO + PbS → 3 Pb + SO2
金属铅暴露于空气中,表面会形成一层致密的薄膜(含氧化铅和碱式碳酸铅)以阻止向金属内部的进一步氧化反应。铅在硫酸和盐酸中较为稳定,但是能溶于硝酸,形成硝酸铅并放出一氧化氮:
- 3 Pb + 8 H+ + 8 NO−
3 → 3 Pb2+ + 6 NO−
3 + 2 NO + 4 H2O
铅和碱金属硝酸盐共热,可以产生一氧化铅(俗称密陀僧),硝酸盐则被还原为亚硝酸盐。一氧化铅可溶于硝酸和乙酸,形成的溶液能够沉淀出微溶或难溶于水卤化物、硫化物、硫酸盐、碳酸盐和铬酸盐。在卤化物中,碘化物的溶解性比溴化物小,溴化物的溶解性比氯化物小。[3]
Pb+NaNO3–>PbO+NaNO2
氧化铅溶解在碱金属氢氧化物溶液中,形成亚铅酸盐。亚铅酸盐和氯气反应,可以得到二氧化铅,其中铅为+4价:[2]
- PbO + 2 OH− + H2O → Pb(OH)2−
4 - Pb(OH)2−
4 + Cl2 → PbO2 + 2 Cl− + 2 H2O
二氧化铅是+4价铅化合物的一个代表,它是一种强氧化剂。而+4价铅的氯化物PbCl4则很不稳定,容易分解为PbCl2并放出氯气。+4价铅的溴化物和碘化物仍属未知。[3]二氧化铅溶解在碱金属氢氧化物溶液中,形成相应的铅酸盐。[2]
- PbO2 + 2 OH− + 2 H2O → Pb(OH)2−
6
铅的另一种氧化物四氧化三铅(Pb3O4)是混合价态氧化物,同时含有+2和+4价铅。
1:1的铅钠合金可以和卤代烃反应,产生有机铅化合物,如四乙基铅。[4]
氧化物和硫化物
[编辑]
铅有多种氧化物,其中PbO、Pb3O4和PbO2是最常见的三种氧化物。PbO有两种结构:α-PbO和β-PbO,这两种氧化铅都具有层状结构,铅原子都是四配位的。α-PbO是红色固体,Pb–O键长为230 pm;β-PbO是黄色固体,Pb–O的键长为221和249 pm(不对称的结构产生了两种键长)。[5]由于两种结构的相似性,它们都能在标准状态下存在(其中β-PbO含有痕量(10−5)的杂质,如Si、Ge、Mo等)。PbO和酸反应形成盐,和碱反应生成[Pb(OH)3]−和[Pb(OH)4]2−。[6]
二氧化铅可以由铅盐和卤素作用产生。α型属于三方晶系,β型属于四方晶系。[6]两种形态均是棕褐色固体,含有无法失去的水,加热二氧化铅会使其分解为一氧化铅或四氧化三铅。二氧化铅是一种强氧化剂,可以氧化盐酸和硫酸,分别放出氯气和氧气。它和强碱反应,生成羟基铅(IV)酸盐,和碱性氧化物反应,生成铅(IV)酸盐。[6]
铅和硫或硫化氢反应,生成硫化铅。硫化铅属于NaCl晶型,简单立方结构,因而有着高熔点(1114℃)。在空气中加热硫化铅,会得到一氧化铅和硫酸铅。[7]硫化铅难溶于水、弱酸、硫化铵或多硫化铵溶液,这使得它在无机定性分析中和锡、砷、锑等元素分离。硫化铅可溶于硝酸和浓盐酸,分别生成硫和硫化氢。[7]硫化铅和一氧化铅共热,可以得到金属铅:[2]
- 2 PbO + PbS → 3 Pb + SO2↑
铅是ⅣA族中唯一能形成稳定的硫醇盐的元素,硫醇(R−SH)和铅(II)盐反应,可以生成黄色的硫醇铅沉淀。硫醇铅易被氧化:[8]
- (RS)2Pb + I2 → R2S2 + PbI2
卤化物
[编辑]

在氟化氢中加热碳酸铅,可以得到氟氢化物,熔融时产生氟化铅。氟化铅是白色晶体,比碘化铅更易溶,但比氯化铅和溴化铅难溶。氟化铅不能形成氟配位的化合物(PbF+阳离子除外)。[9]四氟化铅是黄色晶体粉末,不稳定。
其它二卤化物可以由铅(II)盐和其它金属的卤化物共热得到,沉淀法或单质化合法亦可。这些卤化物属于正交晶系,其溶解度随着温度的升高而变大,向溶液中加入卤化物会先降低其溶解度,之后由于形成配合物(最大配位数为6),溶解度再次增高。配合物的种类取决于离子浓度、卤化物中碱金属的原子序数、卤化物的种类、反应温度及离子强度等因素。[10]四氯化铅可以由二氧化铅溶于浓盐酸得到,易分解。氢溴酸和氢碘酸与二氧化铅反应,只会得到二卤化物及氧化产生的卤素单质。[11]二砹化铅也有报道。[12]
氯配合物
[编辑]铅可以形成一系列的氯配合物,25 °C时,它们的平衡常数如下:[13]
- Pb2+ + Cl− → PbCl+, K1 = 12.59
- PbCl+ + Cl− → PbCl2, K2 = 14.45
- PbCl2 + Cl− → PbCl3−, K3 = 3.98 ×10−1
- PbCl3− + Cl− → PbCl42−, K4 = 8.92 × 10−2
甲胺盐酸盐和氯化铅反应,可以得到甲铵氯铅酸盐([CH3NH3][PbCl3])。溴与碘的配合物也已制得。[14]
含氧酸盐
[编辑]
铅与硫酸或盐酸无明显作用,但是可以溶解在硝酸中,生成硝酸铅(Pb(NO3)2)并放出一氧化氮。[9]硝酸铅易溶于水,但在硝酸溶液中的溶解度较低。硝酸铅于相应的阴离子反应,可以沉淀出卤化铅、硫酸铅、铬酸铅、碳酸铅或碱式碳酸铅等物质。[3]硝酸铅于1597年首次在文献中被描述,德国人安德烈亚斯·利巴菲乌斯在文献中称之为“甜蜜的铅”,这源于硝酸铅尝起来的味道。[15]
乙酸铅(Pb(CH3COO)2)又称醋酸铅、铅糖,铅糖一名也源于其甜味,过去曾作为甜味剂,后来人们发现食入乙酸铅会导致铅中毒,政府便禁止了这一添加剂。[16]乙酸铅和硫化氢反应,可以产生黑色的硫化铅,根据这一性质,乙酸铅制作为试纸被用于检测硫化氢的存在。
碱式碳酸铅(Pb3(OH)2(CO3)2)又称铅白、C.I.颜料白1,曾在19世纪被当作白色颜料使用。[17]由于铅白具有毒性,这一白色颜料逐渐被钛白(TiO2)替代。[18]另一种含铅颜料是铬黄,成分是铬酸铅(PbCrO4)。铬酸铅可由铬酸钠和硝酸铅反应,沉淀得到。它最早于19世纪20年代作为黄色颜料使用。[19]这种物质的缺点除了有毒外,它在空气中会变暗[20],后来被另一种称作“镉黄”的颜料所代替。[21]
铅化合物扮演的另一个角色便是炸药,除了硝酸铅合剂外,苦味酸铅是又一知名的爆炸品。它由苦味酸盐和可溶性铅盐反应,沉淀得到。苦味酸铅对撞击敏感,2 kg的物体从2 cm高处落下即可引爆。[22]
有机铅化合物
[编辑]最著名的有机铅化合物是铅烷衍生物四甲基铅(TML)和四乙基铅(TEL),而六乙基二铅(HEDL)的稳定性就较差,这些化合物中含Pb(IV),Pb–C键为共价键。因此它们是典型的有机铅化合物。[23]
铅和钠形成1:1的合金,与烷基卤化物反应,生成有机铅化合物,如四乙基铅。[24]在四甲基铅和四乙基铅中的Pb–C键键能分别只有167和145 kJ/mol,数据表明这些化合物受热分解。四乙基铅在100 °C(373 K)开始分解,热解产物是单质铅和烷基自由基,它们的相互作用可以产生六乙基二铅。[23]这些化合物在日光或紫外线下也能分解。[25]在氯的存在下,烷基可以被氯取代;在HCl的存在下(前者反应的副产物),R2PbCl2可以完全转变为无机物PbCl2。烷基铅和溴的反应类似。[25]四甲基铅和二氧化硫在水的存在下反应,生成(CH3)2PbSO3;和三氧化硫在潮湿的1,2-二氯乙烷中反应,生成(CH3)2PbSO4;和四氧化二氮在戊烷中反应,生成(CH3)3PbNO3,但在三氯甲烷中反应,生成[(CH3)2Pb(cis-(CH3NO)2)](NO3)2。[26]
环戊二烯基钠和硝酸铅反应,生成铅的环戊二烯配合物二茂铅,它可溶于苯、丙酮、乙醚等有机溶剂,难溶于水,但在冷水中稳定。[27]
四乙酸铅和芳香烃反应,可以直接得到有机铅化合物,如和苯甲醚的反应:[28]
四苯基铅是一种白色固体,难溶于水,可由格氏试剂(苯基溴化镁)和氯化铅在乙醚中反应得到:[29]
- C6H5MgBr + 2 PbCl2 → Pb(C6H5)4 + Pb + 4 MgBrCl
四苯基铅和盐酸反应,生成氯化三苯基铅和二氯化二苯基铅。[30]四苯基铅和硫在150°C以上发生爆炸:[31]
- Pb(C6H5)4 + 3 S → PbS + (C6H5)2S
有机硫化物(C2H5)3Pb-S-Pb(C2H5)3可以由四乙基铅和硫反应得到。硒化物(如(CH3)3Pb-Se-R)、碲化物(如(C6H5)3Pb-Te-Pb(C6H5)3)也有报道。[8]
溶解度相图
[编辑]硫酸铅难溶于水,如图所示,向含0.1 mol/L的Pb2+溶液中滴加SO42−溶液。溶液的pH为4.5,在此pH之上,Pb2+的浓度不会超过0.1 mol/L,这是因为偏高的pH会促进Pb(OH)2的生成。从图中可以看出,在SO42−的浓度为0.1 mol/L时,Pb2+的溶解度下降了10000倍。

|
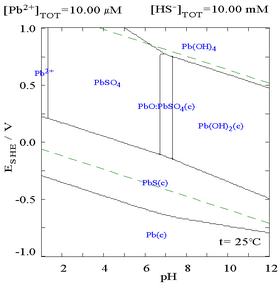
|
| 溶液中溶解的Pb2+与SO42−的关系图[32] | 含铅物种在硫酸盐介质中的电位-pH图[32] |
向含有Pb2+的溶液中滴加Cl−,铅的溶解度变小,当Cl−浓度变得较大时,因形成氯配合物,溶解度再次变大。

|
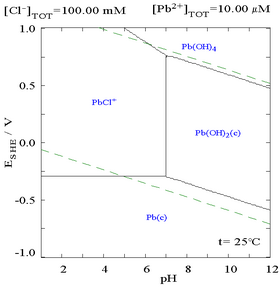
|
| 溶液中Pb(II)与总氯含量的关系图[32] | 含铅物种在氯化物介质中的电位-pH图[32] |
参考文献
[编辑]- ^ Polyanskiy 1986,第14–15頁.
- ^ 2.0 2.1 2.2 2.3 Pauling, Linus. General Chemistry. W.H. Freeman. 1947. ISBN 978-0-486-65622-9.
- ^ 3.0 3.1 3.2 Brady, James E.; Holum, John R. Descriptive Chemistry of the Elements. John Wiley and Sons. 1996. ISBN 978-0-471-13557-9.
- ^ Windholz, Martha. Merck Index of Chemicals and Drugs, 9th ed., monograph 8393. Merck. 1976. ISBN 978-0-911910-26-1.
- ^ Polyanskiy 1986,第21頁.
- ^ 6.0 6.1 6.2 Polyanskiy 1986,第22頁.
- ^ 7.0 7.1 Polyanskiy 1986,第28頁.
- ^ 8.0 8.1 郝润蓉 等. 无机化学丛书 第三卷 碳 硅 锗分族. 科学出版社, 1998. pp. 528. 3. 有机铅的硫族化合物 ISBN 7-03-000129 X/O·40
- ^ 9.0 9.1 Polyanskiy 1986,第32頁.
- ^ Polyanskiy 1986,第33頁.
- ^ Polyanskiy 1986,第34頁.
- ^ Zuckerman, J. J.; Hagen, A. P. Inorganic Reactions and Methods, the Formation of Bonds to Halogens. John Wiley & Sons. 1989: 426. ISBN 978-0-471-18656-4.
- ^ Ward, C. H.; Hlousek, Douglas A.; Phillips, Thomas A.; Lowe, Donald F. Remediation of Firing Range Impact Berms. CRC Press. 2000. ISBN 1566704626.
- ^ Saidaminov, Makhsud I.; Abdelhady, Ahmed L.; Murali, Banavoth; Alarousu, Erkki; Burlakov, Victor M.; Peng, Wei; Dursun, Ibrahim; Wang, Lingfei; He, Yao; MacUlan, Giacomo; Goriely, Alain; Wu, Tom; Mohammed, Omar F.; Bakr, Osman M. (2015). "High-quality bulk hybrid perovskite single crystals within minutes by inverse temperature crystallization". Nature Communications. 6: 7586. PMC 4544059 . PMID 26145157. doi:10.1038/ncomms8586.
- ^ Libavius, Andreas. Alchemia Andreæ Libavii. Francofurti: Iohannes Saurius. 1595.
- ^ Stoeppler, M. (1992), Hazardous Metals in the Environment, Techniques and Instrumentation in Analytical Chemistry, 12, Elsevier, p. 60, ISBN 9780080875606, From the results achieved so far it is obvious that the purity law for lead in wines in the last two centuries was frequently ignored.
- ^ Engel, Gustave (1879). Les produits chimiques à l’Exposition Universelle de Paris en 1878, examinés plus spécialement au point de vue de l’industrie des toiles peintes, Bulletin de la Société Industrielle de Mulhouse. 49 :53-83
- ^ Laver, M. Titanium Dioxide Whites, in Fitzhugh, E.W. (Ed), Artists' Pigments, Vol 3, Oxford university Press, 1997, p. 309
- ^ Kühn, H. and Curran, M., Chrome Yellow and Other Chromate Pigments, in Artists’ Pigments. A Handbook of Their History and Characteristics, Vol. 1, L. Feller, Ed., Cambridge University Press, London 1986, p. 187 – 204, pp 188-190
- ^ Pichon, A. Pigment degradation: Chrome yellow’s darker side. Nature Chemistry, 5(11), 2013, 897–897. doi:10.1038/nchem.1789
- ^ Gettens, Rutherford John; Stout, George Leslie (1966). "Painting Materials: A Short Encyclopaedia". Courier Dover Publications: 106. ISBN 978-0-486-21597-6.
- ^ Urbanski, T.: Chemistry and Technology of Explosives, Vol. 1, Pergamon Press – PWN Polish Scientific Publishers, 1964, S. 525.
- ^ 23.0 23.1 Polyanskiy 1986,第43頁.
- ^ Windholz, Martha. Merck Index of Chemicals and Drugs, 9th ed., monograph 8393. Merck. 1976. ISBN 0-911910-26-3.
- ^ 25.0 25.1 Polyanskiy 1986,第44頁.
- ^ Gmelin Handbook of Inorganic Chemistry (8th Edition). Pb - Organic Compounds Part 1. Springer-Verlag Berlin Heidelberg GmbH, 1987. 1.1.1.1.4.6 With Nonmetal Compounds. pp 140
- ^ Fischer, E. O.; Grubert, H. (1956). "Über Aromatenkomplexe von Metallen. IV. Di-cyclopentadienyl-blei". Zeitschrift für anorganische und allgemeine Chemie. 286 (5–6): 237. doi:10.1002/zaac.19562860507.
- ^ Robert P. Kozyrod and John T. Pinhey (1990). "The C-arylation of β-dicarbonyl compounds". Org. Synth.; Coll. Vol., 7, p. 229
- ^ P. Pfeiffer, P. Truskier: Zur Darstellung organischer Blei- und Quecksilber-Verbindungen. In: Berichte der deutschen chemischen Gesellschaft. Band 37, Nr. 1, Januar 1904, S. 1125, doi:10.1002/cber.190403701183.
- ^ P. Pfeiffer, P. Truskier: Zur Darstellung organischer Blei- und Quecksilber-Verbindungen. In: Berichte der deutschen chemischen Gesellschaft. Band 37, Nr. 1, Januar 1904, S. 1125, doi:10.1002/cber.190403701183.
- ^ Max Schmidt, Herbert Schumann: Spaltungsreaktionen metallorganischer Verbindungen mit Chalkogenen. Reaktionen von Schwefel mit silicium-, germanium- und bleiorganischen Verbindungen. In: Zeitschrift für anorganische und allgemeine Chemie. Band 325, Nr. 3-4, Oktober 1963, ISSN 0044-2313, S. 130, doi:10.1002/zaac.19633250305.
- ^ 32.0 32.1 32.2 32.3 Puigdomenech, Ignasi. Hydra/Medusa Chemical Equilibrium Database and Plotting Software. KTH Royal Institute of Technology. 2004. (原始内容存档于2007-09-29).
参考书目
[编辑]Polyanskiy, N. G. Fillipova, N. A , 编. Аналитическая химия элементов: Свинец [Analytical Chemistry of the Elements: Lead]. Nauka. 1986 (俄语).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||

