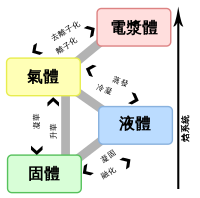
超臨界流體
超臨界流體(英語:Supercritical fluid, SCF)是一種物質狀態,當物質在超過臨界溫度及臨界壓力以上,氣體與液體的性質會趨近於類似,最後會達成一個均勻相之流體現象。超臨界流體類似氣體具有可壓縮性,可以像氣體一樣發生瀉流,而且又兼具有類似液體的流動性,密度一般都介於0.1到1.0g/ml之間。
接近臨界點時,壓力或者溫度的小變化會使密度發生很大變化,因此使得超臨界流體的許多特性可以被「精細調整」。超臨界流體適合作為工業和實驗室過程中的溶劑,而且可以取代許多有機溶劑。二氧化碳和水是最常用的超臨界流體,分別被用於去除咖啡因和發電與萃取。
特性
[編輯]總體而言,超臨界流體的屬性介於氣體和液體之間。在表1顯示,顯示一些常用作超臨界流體的化合物之臨界性質。
| 物質 | 分子質量 | 臨界溫度 | 臨界壓力 | 臨界密度 |
|---|---|---|---|---|
| 克/莫耳 | K | 百萬帕(標準大氣壓) | g/cm3 | |
| 二氧化碳(CO2) | 44.01 | 304.1 | 7.38 (72.8) | 0.469 |
| 水(H2O,依IAPWS資料) | 18.015 | 647.096 | 22.064 (217.755) | 0.322 |
| 甲烷(CH4) | 16.04 | 190.4 | 4.60 (45.4) | 0.162 |
| 乙烷(C2H6) | 30.07 | 305.3 | 4.87 (48.1) | 0.203 |
| 丙烷(C3H8) | 44.09 | 369.8 | 4.25 (41.9) | 0.217 |
| 乙烯(C2H4) | 28.05 | 282.4 | 5.04 (49.7) | 0.215 |
| 丙烯(C3H6) | 42.08 | 364.9 | 4.60 (45.4) | 0.232 |
| 甲醇(CH3OH) | 32.04 | 512.6 | 8.09 (79.8) | 0.272 |
| 乙醇(C2H5OH) | 46.07 | 513.9 | 6.14 (60.6) | 0.276 |
| 丙酮(C3H6O) | 58.08 | 508.1 | 4.70 (46.4) | 0.278 |
表2示出了典型的液體,氣體和超臨界流體的密度,擴散係數和粘度。
| 密度(kg/m3) | 黏度(µPa∙s) | 擴散係數(mm²/s) | |
|---|---|---|---|
| 氣體 | 1 | 10 | 1–10 |
| 超臨界流體 | 100–1000 | 50–100 | 0.01–0.1 |
| 液體 | 1000 | 500–1000 | 0.001 |
在超臨界流體中沒有液體及氣體之間的相界限,因此不存在表面張力,藉由改變流體的壓力和溫度,可以微調超臨界流體的特性,使其更類似液體或是氣體。物質在流體中的溶解度即為重要特性之一,在固定溫度條件下,溶解度會隨流體密度增加而增加。由於密度也是隨壓力增加而增加,因此在壓力增加時,溶解度也會增加。溶解度和溫度的關係比較複雜,在固定密度條件下,溶解度會隨溫度增加而增加,但靠近臨界點時,溫度輕微的增加會造成密度的大幅下降。因此靠近臨界點時,隨著溫度上昇,溶解度會先下降,然後再上昇[2]。
二種以上的超臨界流體,只要溫度及壓力超過其臨界點,二者均可以混溶,形成單一相的混合物。二元混合物的臨界點可以用二超臨界流體的臨界溫度及臨界壓力,再配合加權平均求得:
- Tc(mix) = (A的莫耳分率)x A的Tc + (B的莫耳分率)x B的Tc
若要有更高的準確度,臨界點可以用像是彭-羅賓遜物態方程式之類的狀態方程式求得,或是用基團貢獻(group contribution)法求得,像密度之類的其他性質,也可以用狀態方程式來計算[3]。
相圖
[編輯]
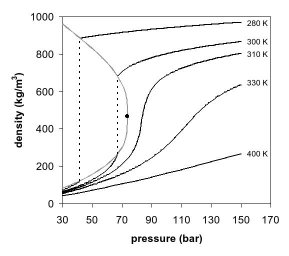
圖1是二氧化碳的相圖,在壓力-溫度的相圖中,液態和氣態為不同的二相,但若超過臨界點,液態和氣態的相態都消失了,變成單一相態的超臨界流體。圖2是二氧化碳密度-壓力的相圖,其中也可以看到類似的現象,當溫度遠低於臨界溫度280K時,隨著壓力的增加,氣體會被壓縮,最後(約40巴壓力時)會凝結成密度高很多的液體,因此相圖中有表示不連續的垂直虛線。此系統包括高密度的液體及低密度的氣體,二者達到平衡狀態。隨著溫度的升高,氣體的密度會增加,而液體的密度會減少。在臨界點304.1 K及7.38 MPa(73.8巴)時,液體和氣體的密度相同,因此變成一均勻相(超臨界二氧化碳)。
溫度高於臨界溫度的氣體無法單純用加壓的方式液化。若溫度略高於臨界溫度(310K),壓力在臨界壓力附近時,密度對壓力的曲線幾乎是垂直線,因此微小的壓力變化就會使超臨界流體的密度有很大的改變。像黏度、相對電容率及溶劑強度等物理量都和密度有關,在臨界點附近這些物理量也會隨壓力有很大的變化。在溫度更高時,超臨界流體的行為開始類似氣體,當溫度到400K時,隨著壓力的變化,密度幾乎呈線性的變化。
許多壓縮氣體其實都是超臨界流體。例如氮的臨界點是126.2 K(- 147 °C)及3.4 MPa(34巴),因此若壓力容器中的氮氣壓力及溫度大於臨界點,氮氣就已變為超臨界流體。在室溫下,氮氣和氧氣的溫度遠高於臨界點,因此其特性類似氣體。不過這些氣體除非冷卻到其臨界溫度以下,否則是無法液化的。
自然界的超臨界流體
[編輯]海底火山
[編輯]
海底火山常見於海底的地表。有些在較淺海域的海底活火山會釋放蒸汽及岩石碎片,而且噴出至較海平面高很多的高度。但許多海底火山在很深的海域,巨大的海水壓力使蒸汽和氣體無法爆炸性釋放。例如深度超過3000公尺的海域,其壓力到300個大氣壓,已超過臨界壓力的218大氣壓,而且噴口的水溫也會超過374.2℃(≒374.15℃),因此噴口最熱的水會變成超臨界流體。
行星大氣
[編輯]金星大氣層含有96.5%的二氧化碳和3.5%的氮。金星表面壓力為9.3百萬帕(93巴),表面溫度為735 K,壓力及溫度都高於主要成分的臨界點,因此使金星表面大氣成為超臨界流體。
太陽系中的氣態巨行星內部大氣的主要成分是氫與氦,其溫度遠遠高於臨界點。木星和土星的大氣,在星球表面為氣態,往星球內部逐漸變為液體。但海王星和天王星上,這種轉變還不太為人所了解。太陽系外行星巨蟹座55e和格利澤876d的理論模型,二者都沉積了以超臨界水形式存在的海洋,底部是一層高壓冰。
用途
[編輯]超臨界流體萃取
[編輯]因為超臨界流體具有低粘度和高擴散係數,因此相較於一般的液體萃取,超臨界流體萃取可以有較快的萃取速度。藉由調整超臨界流體的密度,可以進行選擇性的萃取,而且在不加壓的情形下,超臨界流體會蒸發,殘留溶劑的量非常少,甚至沒有殘留。二氧化碳是最常用的超臨界流體溶劑,大量用在生咖啡豆的去咖啡因製程,或是在啤酒製造中用來萃取啤酒花中的成份[4],或是從植物中提煉精油及藥品。許多實驗室的測試方法已將超臨界流體萃取作為萃取的方式之一,取代使用傳統溶劑的萃取法[5][6][7]。
超臨界流體分解
[編輯]利用超臨界水可氣化生物質的特性,可以進行生物質的分解。[8] 這種生物質的氣化可以用來製造烴類燃料,用在高效的燃燒裝置中,或用於產生燃料電池所需要的氫氣。在後者的應用,由於在水蒸汽轉化過程中,水也可以參與反應,提供氫原子,因此氫氣產量可以遠高於生物質中的氫含量。
乾洗
[編輯]超臨界二氧化碳可以代替乾洗中的四氟乙烯等傳統有機溶劑,傳統溶劑會污染環境,而超臨界二氧化碳溶劑對環境友好,對健康無害,易於循環利用。超臨界二氧化碳用於乾洗的一缺點是,洩壓過程中會對鈕扣、拉鏈等造成損害。[9] 溶於超臨界二氧化碳的清潔劑可以提高超臨界二氧化碳的溶解能力。[10]
超臨界流體色譜
[編輯]超臨界流體色譜兼有氣相色譜和高效液相色譜的優點。超臨界流體色譜可以分析易揮發和熱不穩定的分析物(氣相色譜無法做到),還可以分析火焰離子化檢測器(液相色譜無法做到),超臨界流體色譜另外一個優點是能夠產生比較窄的峰。不過實務上超臨界流體色譜還不能完全取代廣泛使用的氣相色譜和液相色譜,只有在像手性分離及高分子量碳水化合物分析才會使用超臨界流體色譜[11]。 製造業上已經有了模擬移動床裝置。[12] 最終產物的純度非常高,但成本也非常高,只適用於製備如藥物等高價值的材料。
化學反應
[編輯]改變反應溶劑的條件,可以使反應體系為均勻相,便於反應進行,或者使體系發生相分離,以便分離反應產物。快速擴散能加快擴散控制型反應的進行。溫度及壓力可以調整反應依特定的反應路徑進行,以產生特定的手性異構物[13]。超臨界流體對環境的影響也比傳統的有機溶劑要小。
製備藥物共晶
[編輯]超臨界流體是製備活性藥物成分的新異晶體結構——藥物共晶的新介質。藥物共晶粒子可以通過超臨界流體技術一步合成,這是傳統方法很難甚至不可能做到的。超臨界流體的多種性質(如超臨界二氧化碳強溶解性、抗溶劑效應、霧化增強)可用於製備純的和乾燥的新藥物共晶——由活性藥物成分、由一種或多種晶格構象異構物組成的結晶分子錯合物。[14][15]
製備納米和微米粒子
[編輯]製備窄分布粒徑的小粒子是製藥業和其他工業技術上非常重要的過程。應用超臨界流體可以有多種方法使溶質快速超過飽和點,比如通過稀釋、減壓,或二者兼而用之。這些過程在超臨界流體裡要比在通常的液體裡發生得更快,使成核或失穩相分離壓過晶體生長,產生非常小的、粒徑均勻的粒子。超臨界流體可以制出粒徑大小在5—2000納米範圍內的粒子[16]。
超臨界乾燥
[編輯]超臨界乾燥是一種去除溶劑並且不引起表面張力效應的方法。隨著液體的蒸發,表面張力會拖曳固體中的小結構,造成固體扭曲或收縮。在超臨界條件下,不存在表面張力,清除超臨界流體不會影響固體形狀。超臨界乾燥用於製造氣凝膠,乾燥一些易被破壞的材料,如考古樣品或是用於電子顯微鏡實驗的樣品[17]。
超臨界水氧化
[編輯]超臨界水氧化以超臨界水作為介質,氧化危險廢物和清除有毒燃燒產物。
超臨界流體發電
[編輯]熱機的熱效率和高低溫熱源之間的溫度差有關。若要調高發電廠的效率就需要調高工作溫度。若用超臨界的水做為工作流體,現在的技術可提昇熱機效率,由非臨界條件下的39%提高到45%。[18] 超臨界水反應爐是一種很有發展性的核系統,也可以依類似原理提高熱效率,核系統中也可以使用超臨界二氧化碳,有類似的效果。[19]。燃煤發電的超臨界機組已經非常常見,比傳統的火電廠效率提高很多。
歷史
[編輯]1822年,卡尼亞爾·德·拉·圖爾男爵在進行實驗時發現超臨界流體的特性,他將炮管密封,其中加入不同溫度的流體,再放入燧石的小球,球在炮管中滾動時會有聲音的不連續變化;但當溫度超過臨界溫度時,聲音的不連續變化消失了,炮管的流體中液體和氣體的密度變得相同,變成一個超臨界流體的相,因此也沒有二相之間的相界限[20]。
參看
[編輯]參考資料
[編輯]- ^ Edit Székely. Supercritical Fluid Extraction. Budapest University of Technology and Economics. [2007-11-20]. (原始內容存檔於2007-10-24).
- ^ Supercritical Fluid Extraction, Density Considerations. [2007-11-20]. (原始內容存檔於2021-04-28).
- ^ A.A. Clifford. Calculation of Thermodynamic Properties of CO2 using Peng Robinson equation of state.. Critical Processes Ltd. 2007-12-04 [2007-11-20]. (原始內容存檔於2008-05-05).
- ^ The Naked Scientist Interviews. [2007-11-20]. (原始內容存檔於2015-04-16).
- ^ U.S.EPA Method 3560 Supercritical Fluid Extraction of Total Recoverable Hydrocarbons. http://www.epa.gov/SW-846/pdfs/3560.pdf Archive-It的存檔,存檔日期2008-12-17
- ^ U.S.EPA Method 3561 Supercritical Fluid Extraction of Polycyclic Aromatic Hydrocarbons. http://www.epa.gov/SW-846/pdfs/3561.pdf
- ^ Use of Ozone Depleting Substances in Laboratories. TemaNord 2003:516. 存档副本 (PDF). [2011-03-28]. (原始內容 (PDF)存檔於2008-02-27).
- ^ Supercritical water gasification of biomas. Iowa Energy Center. [201-11-17]. (原始內容存檔於2015-03-25).
- ^ 侯愛芹 戴瑾瑾. 二氧化碳在纺织领域应用的研究进展. 紡織導報. 2004, (2): 67–80.
- ^ Science News Online. [2007-11-20]. (原始內容存檔於2013-05-09).
- ^ Bart, C. J. Chapter 4: Separation Techniques. Additives in Polymers: industrial analysis and applications. John Wiley and Sons. 2005: 212. ISBN 978-0-470-01206-2. doi:10.1002/0470012064.ch4.
- ^ Simulated Moving Bed Theory (PDF). [2007-11-20]. (原始內容 (PDF)存檔於2004-08-29).
- ^ R. Scott Oakes, Anthony A. Clifford, Keith D. Bartle, Mark Thornton Pett and Christopher M. Rayner. Sulfur oxidation in supercritical carbon dioxide: dramatic pressure dependent enhancement of diastereoselectivity for sulphoxidation of cysteine derivatives. Chemical Communications. 1999, (3): 247–248. doi:10.1039/a809434i.
- ^ L. Padrela, M.A. Rodrigues, S.P. Velaga, H.A. Matos and E.G. Azevedo (2009). "Formation of indomethacin–saccharin cocrystals using supercritical fluid technology". European Journal of Pharmaceutical Sciences. 38, pp. 9–17. doi:10.1016/j.ejps.2009.05.010
- ^ L. Padrela, M.A. Rodrigues, S.P. Velaga, H.A. Matos and E.G. Azevedo (2009). "Screening for pharmaceutical cocrystals using the supercritical fluid enhanced atomization process". Journal of Supercritical Fluids. article in press, corrected proof. doi:10.1016/j.supflu.2010.01.010
- ^ Sang-Do Yeob and Erdogan Kirana. Formation of polymer particles with supercritical fluids: A review. The Journal of Supercritical Fluids. 2005, 34 (3): 287–308. doi:10.1016/j.supflu.2004.10.006.
- ^ http://dx.doi.org/10.1016/j.cemconres.2017.05.005
- ^ Supercritical steam cycles for power generation applications (PDF). [2007-11-20]. (原始內容 (PDF)存檔於2008-12-17).
- ^ Dostal, M.J. Driscoll, P. Hejzlar. A Supercritical Carbon Dioxide Cycle for Next Generation Nuclear Reactors (PDF). MIT-ANP-TR-100. MIT-ANP-Series. [2007-11-20]. (原始內容 (PDF)存檔於2010-12-27).
- ^ Berche, Bertrand; Henkel, Malte; Kenna, Ralph. Critical phenomena: 150 years since Cagniard de la Tour. Journal of Physical Studies. 2009, 13 (3): 3001–1–3001–4 [2013-03-19]. (原始內容存檔於2021-04-17).
外部連結
[編輯]- Handy calculator for density, enthalpy, entropy and other thermodynamic data of supercritical CO2
- Food Product Design
- CO2 as a natural refrigerant - FAQs
- animated presentation describing what a supercritical fluid is
- NewScientist Environment FOUND:The hottest water on Earth (頁面存檔備份,存於網際網路檔案館)