三氧化二硼
| 三氧化二硼 | |
|---|---|
| |
| 别名 | 三氧化二硼、硼酸酐、硼酐 |
| 识别 | |
| CAS号 | 1303-86-2 |
| PubChem | 518682 |
| ChemSpider | 452485 |
| SMILES |
|
| InChI |
|
| InChIKey | JKWMSGQKBLHBQQ-UHFFFAOYAI |
| EINECS | 215-125-8 |
| ChEBI | 30163 |
| RTECS | ED7900000 |
| 性质 | |
| 化学式 | B2O3 |
| 摩尔质量 | 69.6182 g·mol⁻¹ |
| 外观 | 白色蜡状固体 |
| 密度 | 2.460 g/cm3 (液态) |
| 熔点 | 450 °C |
| 沸点 | 1680 °C |
| 溶解性(水) | 2.2 g/100 mL |
| 溶解性 | 在甲醇中部分可溶 |
| pKa | ~ 4 |
| 危险性 | |
| 欧盟分类 | Repr. Cat. 2 |
| 致死量或浓度: | |
LD50(中位剂量)
|
3150 mg/kg (小鼠口服) |
| 相关物质 | |
| 其他阴离子 | 硫化硼 硒化硼 碲化硼 |
| 其他阳离子 | 氧化鋁 氧化鎵 氧化銦 氧化鉈 |
| 相关化学品 | 一氧化二硼 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
三氧化二硼(化学式:B2O3)又称氧化硼,是硼最主要的氧化物。它是一种白色蜡状固体,一般以无定形的状态存在,很难形成晶体,但在高强度退火后也能结晶。它是已知的最难结晶的物质之一。
结构
[编辑]玻璃状氧化硼(g-B2O3)很可能是一种由许多三角形BO3单元通过共用氧原子部分有序连接而成的网络结构,其中以硼氧相间的六元环B3O3占优势。该六元环中,硼原子为三配位,氧原子为二配位。[1][2]该玻璃体在325-450 °C时软化,其密度随受热情况而有一个变化范围。加热时,玻璃体氧化硼结构中的无序度增加。超过450 °C时会产生有极性的-B=O基。高于1000 °C时,氧化硼蒸气则全部由B2O3单体组成,其结构为角形的 O=B-O-B=O。
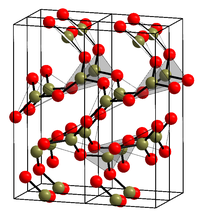
常压下使液态的氧化硼在200-250 °C范围内结晶,可以形成普通的六方晶系氧化硼(α-B2O3),其结构(见右图)[3]几乎全部由三角形的BO3单元组成。
在22000atm和400 °C时,α-B2O3转变为高温高压型的单斜晶体β-B2O3。[4]该转变过程类似于石英在高压下到柯石英的转化。除此之外,β-B2O3也可以由液态氧化硼在40000atm和600 °C时结晶得到。
β-B2O3的体积模量很大(K = 180 GPa)。g-B2O3和β-B2O3的维氏硬度分别为1.5GPa和16GPa。[5]
制备
[编辑]虽然硼在空气和氧气中燃烧都可以直接产生三氧化二硼,但三氧化二硼主要是通过硼酸脱水制取的。在200-400 °C对硼酸真空脱水,可以得到非常干燥的三氧化二硼。如果在大气中脱水,即使加热到1000 °C,也很难去除最后剩下的痕量水。
化学性质
[编辑]氧化硼是酸性氧化物,熔融时可以溶解许多碱性的金属氧化物,生成有特征颜色的玻璃状硼酸盐和偏硼酸盐(玻璃)。这是硼砂珠试验定性鉴别金属的原理。例如:
- (蓝色)
- (黄色)
反应后用盐酸处理反应混合物,MgO、B2O3和Mg溶于盐酸,过滤后得到粗硼。氧化硼在高温时不能为碳还原(高温下可以形成碳化硼)。高温下氧化硼与碳和氯气反应,可以得到三氯化硼:
600 °C时,氧化硼与氨反应可以得到氮化硼(BN),与氢化钙反应则得到六硼化钙(CaB6)。
- ,
应用
[编辑]氧化硼可以用作:
- 制取其他硼化合物(如碳化硼)的原料;
- 制造硼矽酸鹽玻璃的原料;
- 有机合成中的酸性催化剂;
- 搪瓷、陶瓷釉料的助熔剂;
- 玻璃纤维生产过程中的添加剂;
- 制造化合物半导体(如砷化镓、磷化镓、砷化铟)时的液封剂等。
参见
[编辑]参考资料
[编辑]- ^ Eckert, H. Prog. NMR Spectrosc., 24 (1992) 159-293.
- ^ S.-J. Hwang, C. Femandez, J.P. Amoureux, J. Cho, S.W. Martin & M. Pruski. "Quantitative study of the short range order in B,O, and B,S, by MAS and two-dimensional triple-quantum MAS 11B NMR" Solid State Nuclear Magnetic Resonance 8 (1997) 109-121
- ^ G.E. Gurr, P.W. Montgomery, C.D. Knutson, B.T.Gorres "The Crystal Structure of Trigonal Diboron Trioxide" Acta Cryst. B26 (1970) 906-915
- ^ V. V. Brazhkin et al. "Structural transformations in liquid, crystalline and glassy B2O3 under high pressure" JETPh Lett. 78 (2003) 845 (页面存档备份,存于互联网档案馆)
- ^ 5.0 5.1 V. A. Mukhanov, O. O. Kurakevich, and V. L. Solozhenko "On the Hardness of Boron (III) Oxide" of Superhard Materials 30 (2008) 71
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
|









