二氯化钼
外观
| 二氯化钼 | |
|---|---|

| |
| IUPAC名 dichloromolybdenum dodecachlorohexamolybdenum(II) | |
| 别名 | 氯化钼(II) |
| 识别 | |
| CAS号 | 13478-17-6(MoCl2) 11062-51-4(Mo6Cl12) |
| PubChem | 83514 |
| ChemSpider | 75349 |
| SMILES |
|
| InChI |
|
| InChIKey | BQBYSLAFGRVJME-LYAHSSGUAS |
| 性质 | |
| 化学式 | Cl12Mo6 |
| 外观 | 黄色晶体 |
| 密度 | 3.17 g/cm3 |
| 熔点 | 530 °C(803 K) |
| 溶解性(水) | 低 |
| 相关物质 | |
| 相关化学品 | 三氯化钼 四氯化钼 五氯化钼 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
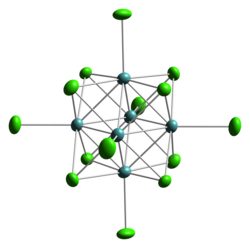
二氯化钼是一种无机化合物,化学式为Mo6Cl12,有时简写为实验式MoCl2。这种化合物有着数百种衍生物,例如含有MoII阴离子的盐八氯合二钼酸钾(K4Mo2Cl8)。
结构[编辑]
二氯化钼不具有典型的金属二卤化物(如氯化镉)的密排结构,而是形成了簇合物结构。二价钼可以形成很大的离子,并有倾向形成有金属-金属键的化合物,如金属簇合物。实际上,在前过渡金属(钛、钒、铬、锰族)中,金属的“低卤化物”(卤素/金属的比例<4)都是已知的。Mo6Cl12是聚合物,由立方的 Mo6Cl84+ 簇以氯原子配体桥联两个原子簇。这种化合物会形成阴离子[Mo6Cl14]2−。在这个离子里,每个钼原子都连接一个氯原子。Mo6簇处于八面体环境中,八个顶点为氯原子。所以,钼原子的配位环境中,有四个三桥氯、相邻四个钼源自,以及一个端基氯原子。[1]

制备和反应[编辑]
- 12 MoCl5 + 18 Mo → 5 Mo6Cl12
这个反应也会生成MoCl3和MoCl4,而它们也会被过量的金属钼还原。该反应在600~650 °C的管式炉中发生。[2]
Mo6Cl12进行的许多反应都会保留Mo612+簇,如它和盐酸共热会产生(H3O)2[Mo6Cl14]。桥联的氯原子可以被其它基团取代:
- (H3O)2[Mo6Cl14] + 6 HI → (H3O)2[Mo6Cl8I6] + 6 HCl
在极端环境下,14个氯原子都可以取代,形成含[Mo6Br14]2−或[Mo6I14]2−的盐。
相关簇合物[编辑]
[Mo6Cl14]2−有很多相关簇合物。钨的类似物质是已知的。Ta和Nb也会形成类似的簇合物。Ta6是一个八面体,氯原子则是在边角的位置。它的化学式为 [Ta6Cl18]4−。
硫化物和硒化物的类似物也是已知的。[Re6Se8Cl6]4−有和[Mo6Cl14]2−一样的价电子数。[3]
Mo-S簇合物Mo6S8L6可通过在供体配体L存在下使硫化物源与Mo6Cl12反应,制备了“谢弗雷尔相”的类似物。 [4]
参考资料[编辑]
- ^ von Schnering, H. G.; May, W.; Peters, K. Crystal structure of dodecachlorooctahedrohexamolybdenum, Mo6Cl12. Zeitschrift für Kristallographie. 1993, 208 (2): 368–369. Bibcode:1993ZK....208..368V. doi:10.1524/zkri.1993.208.Part-2.368.
- ^ Larson, Melvin L.; Nannelli, Piero; Block, B. P.; Edwards, D. A.; Mallock, A. K. Preparation of Some Metal Halides Anhydrous Molybdenum Halides and Oxide Halides-a Summary: Molybdenum(II) Halides. Inorganic Syntheses 12. 2007: 165. ISBN 9780470132432. doi:10.1002/9780470132432.ch29.
- ^ Lee, Sonny C.; Holm, Richard H. Nonmolecular Metal Chalcogenide/Halide Solids and Their Molecular Cluster Analogues. Angewandte Chemie International Edition in English. 1990, 29 (8): 840. doi:10.1002/anie.199008401.
- ^ Saito, Taro. Group 6 Metal Chalcogenide Cluster Complexes and their Relationships to Solid-State Cluster Compounds. Advances in Inorganic Chemistry 44. 1996: 45–91. ISBN 9780120236442. doi:10.1016/S0898-8838(08)60128-2.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||