三氯化鈰
| 三氯化鈰[1] | |||
|---|---|---|---|

| |||
| |||
| IUPAC名 Cerium(III) chloride Cerium trichloride | |||
| 別名 | 氯化鈰(III) | ||
| 識別 | |||
| CAS號 | 7790-86-5(無水) 16651-27-7(六水) 18618-55-8(七水) | ||
| PubChem | 24636 | ||
| ChemSpider | 23038 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | VYLVYHXQOHJDJL-DFZHHIFOAZ | ||
| ChEBI | 35458 | ||
| 性質 | |||
| 化學式 | CeCl3 | ||
| 外觀 | 白色潮解粉末 | ||
| 密度 | 3.97 g/cm3 | ||
| 熔點 | 817 °C (無水物) 90 °C (七水合物分解) | ||
| 沸點 | 1727 °C | ||
| 溶解性(水) | 100 g/100 ml | ||
| 溶解性(其他) | 可溶於乙醇、丙酮 | ||
| 結構 | |||
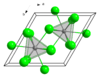
| 晶體結構 | 六方晶系,hP8 | ||
| 空間群 | P63/m, No. 176 | ||
| 危險性 | |||
| 警示術語 | R:R36/37/38 | ||
| 安全術語 | S:S26, S36 | ||
| 歐盟分類 | 刺激性 (Xi) | ||
| 閃點 | 不可燃 | ||
| 致死量或濃度: | |||
LD50(中位劑量)
|
2111 mg/kg (大鼠經口)[2] | ||
| 相關物質 | |||
| 其他陰離子 | 三氟化鈰 三溴化鈰 三碘化鈰 | ||
| 其他陽離子 | 氯化鑭 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
三氯化鈰,別名氯化鈰、氯化鈰(III),化學式CeCl3。
性質
[編輯]無色易潮解塊狀結晶或粉末。露置於潮濕空氣中時,迅速吸收水分生成組成不定的水合物。[3]易溶於水,可溶於乙醇和丙酮。[4]
水合物直接在空氣中加熱時會發生少量水解。[5]若在真空中加熱七水合物數小時逐漸至140°C,則可得到無水三氯化鈰,根據Encyclopedia of Reagents for Organic Synthesis,在70-100°C時晶體已經可以脫去大量的水,可在此溫度維持一段時間再提升溫度,加熱時並須同時使用攪拌子攪拌晶體,最後所生成產物為粉狀固體,可以儲存於乾燥箱中,使用前需再加熱抽真空除水。[4][6][7]用此法製得的無水三氯化鈰可能還含有少量水解產物CeOCl,但已經可與有機鋰試劑和格氏試劑共用,用於有機合成。
純的無水三氯化鈰可通過①將水合物在高真空中和4~6倍氯化銨存在下緩慢加熱至400°C,[5][8][9][10]或②將水合物與過量氯化亞碸共熱3小時而製得。[5][11]此外還可以通過單質鈰與氯氣化合製備無水三氯化鈰。[12][13]它一般通過在高真空下高溫升華純化。
製備
[編輯]將稀土硫酸銨復鹽與氫氧化鈉反應,轉化為氫氧化稀土。再用空氣將後者中的鈰氧化為四價鈰,以稀鹽酸浸出使鈰富集,再經溶解、萃取、結晶,製得三氯化鈰。
用途
[編輯]用作製取鈰和其他鈰鹽的原料、石油催化劑,以及有機合成中的路易斯酸等。三氯化鈰可作三氟甲磺酸鈰的製取原料,後者是有機合成中的路易斯酸,用於傅-克酰基化反應。三氯化鈰自身也是一種路易斯酸,用於傅-克烷基化反應。[14]
七水合三氯化鈰與硼氫化鈉共用時可作為Luche還原反應[15]中的試劑。該反應是有機合成中將α,β-不飽和酮還原的常用方法之一。例如,香芹酮在三氯化鈰和硼氫化鈉共同作用下,可以控制只有羰基雙鍵被還原,生成(1),而不產生(2);而無三氯化鈰時,產物則為(1)和(2)的混合物。
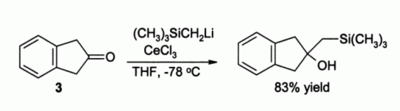
另一例子是用三氯化鈰促進的酮的烷化反應。此法避免了使用有機鋰試劑時產生的烯醇負離子。[6]
參考資料
[編輯]- ^ Record of Cer(III)-chlorid in the GESTIS Substance Database from the IFA.
- ^ 存档副本 (PDF). [2009-11-27]. (原始內容 (PDF)存檔於2007-09-27).
- ^ Alfa 和 Strem 等主要試劑生產商在產品目錄上將三氯化鈰水合物的化學式標為 CeCl3·xH2O。 Aldrich 則提供七水物。
- ^ 4.0 4.1 Paquette, L. A. Coates, R. M.; Denmark, S. E. (eds.) , 編. Handbook of Reagents for Organic Synthesis: Reagents, Auxiliaries and Catalysts for C-C Bond Formation. New York: Wiley. 1999. ISBN 0471979244.
- ^ 5.0 5.1 5.2 Edelmann, F. T.; Poremba, P. Herrmann, W. A. (ed.) , 編. Synthetic Methods of Organometallic and Inorganic Chemistry VI. Stuttgart: Georg Thieme Verlag. 1997. ISBN 3131030216.
- ^ 6.0 6.1 Johnson, C. R.; Tait, B. D. A cerium(III) modification of the Peterson reaction: methylenation of readily enolizable carbonyl compounds. Journal of Organic Chemistry. 1987, 52 (2): 281–283. ISSN 0022-3263.
- ^ Dimitrov, Vladimir; Kostova, Kalina; Genov, Miroslav. Anhydrous cerium(III) chloride — Effect of the drying process on activity and efficiency. Tetrahedron Letters. 1996, 37 (37): 6787–6790. doi:10.1016/S0040-4039(96)01479-7.
- ^ Taylor, M. D.; Carter, P. C. Preparation of anhydrous lanthanide halides, especially iodides. Journal of Inorganic and Nuclear Chemistry. 1962, 24 (4): 387–391. doi:10.1016/0022-1902(62)80034-7.
- ^ Kutscher, J.; Schneider, A. Inorg. Nucl. Chem. Lett. 1971, 7: 815. 缺少或
|title=為空 (幫助) - ^ Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements. New York: Pergamon Press. 1984. ISBN 0080220568.
- ^ Freeman, J. H.; Smith, M. L. The preparation of anhydrous inorganic chlorides by dehydration with thionyl chloride. Journal of Inorganic and Nuclear Chemistry. 1958, 7 (3): 224–227. doi:10.1016/0022-1902(58)80073-1.
- ^ Druding, L. F.; Corbett, J. D. Journal of the American Chemical Society. 1961, 83: 2462–2467. ISSN 0002-7863. 缺少或
|title=為空 (幫助) - ^ Corbett, J. D. Rev. Chim. Minerale. 1973, 10: 239. 缺少或
|title=為空 (幫助) - ^ Mine, Norioki; Fujiwara, Yuzo;Taniguchi, Hiroshi. Trichlorolanthanoid (LnCl3)-catalyzed Friedel-Crafts alkylation reactions. Chemistry Letters. 1986, 15 (3): 357–360. doi:10.1246/cl.1986.357.
- ^ Luche, Jean-Louis; Rodriguez-Hahn, Lydia; Crabbé, Pierre. Reduction of natural enones in the presence of cerium trichloride. Journal of the Chemical Society, Chemical Communications. 1978: 601–602. doi:10.1039/C39780000601.