氯化亚砜
| 氯化亚砜 | |
|---|---|

| |

| |

| |
| IUPAC名 Sulfurous dichloride | |
| 别名 | 亚硫酰氯,二氯亚砜 |
| 识别 | |
| CAS号 | 7719-09-7 |
| PubChem | 24386 |
| ChemSpider | 22797 |
| SMILES |
|
| InChI |
|
| InChIKey | FYSNRJHAOHDILO-UHFFFAOYAN |
| UN编号 | 1836 |
| EINECS | 231-748-8 |
| ChEBI | 29290 |
| RTECS | XM5150000 |
| 性质 | |
| 化学式 | SOCl2 |
| 摩尔质量 | 118.97 g·mol⁻¹ |
| 外观 | 无色或黄色有气味的液体 |
| 密度 | 1.638 g/mL |
| 熔点 | −104.5 °C |
| 沸点 | 76 °C |
| 溶解性(水) | 反应 |
| 黏度 | 0.6 cP |
| 结构 | |
| 分子构型 | 锥体 |
| 偶极矩 | 1.4 D |
| 危险性 | |
| 欧盟危险性符号 | |
| 警示术语 | R:R14-R20/22-R29-R35 |
| 安全术语 | S:S1/2-S26-S36/37/39-S45 |
| MSDS | External MSDS |
| NFPA 704 | |
| 闪点 | 不可燃 |
| 相关物质 | |
| 相关化学品 | 硫酰氯、二氯氧化硒 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
氯化亚砜,又名亚硫酰氯、氯化亚硫酰、二氯亚砜等,是一种无机化合物,化学式是SOCl2。常温常压下,它是无色或黄色、可蒸馏的液体,140°C时分解。SOCl2有时易与硫酰氯(SO2Cl2)相混淆,但它们的化学性质差别很大。
历史
[编辑]氯化亚砜是在1849年由二氧化硫和五氯化磷的反应首次合成的。[1][2]大约1900年,人们发现到它可以作为氯化剂后,就开始以工业规模生产和使用。[3]
制取
[编辑]其他制取方法包括:
性质和结构
[编辑]氯化亚砜的分子构型为锥体型,其中硫(IV)中心含有一对孤对电子。而COCl2则是平面构型。
由于氯化亚砜与水强烈反应,SOCl2不会在自然界存在。
氯化亚砜是无色或淡黄色发烟液体,有强刺激性气味。遇水或醇分解成二氧化硫和氯化氢。对有机分子中的羟基有选择性取代作用。本物质可溶于苯、氯仿、二硫化碳和四氯化碳。加热至150°C开始分解,500°C分解完全。
有机合成
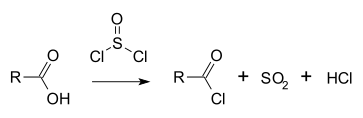
[编辑]氯化亚砜被广泛用来将羧酸[5][6]和醇[7][8]转化成对应的酰氯和氯代烃。和其他试剂(如五氯化磷)相比,氯化亚砜往往是首选试剂,因其反应产物二氧化硫和氯化氢均为气态,易于分离。过剩的氯化亚砜可由蒸馏除去。
值得注意的是,这个反应的产物随着溶剂的不同而有所改变:如果反应的介质为醚类,则产物中氯所连的碳构型与反应物的保持不变;如果反应介质为吡啶,则产物中氯所连的碳构型相对于反应物的进行了一次翻转。
磺酸与氯化亚砜反应生成磺酰氯。[9][10]亚磺酸与氯化亚砜反应生成亚磺酰氯。[11][12]膦酸与氯化亚砜反应生成膦酰氯。
亚硫酰氯可以与单取代的甲酰胺反应生成相应的异腈。[13]酰胺可与氯化亚砜反应生成亚胺酰氯,一级酰胺与氯化亚砜共热时还会继续被脱水为腈类。[14]
除了可以作为氯化剂外,氯化亚砜还能发生硫化反应:[15]
- PhPH2 + SOCl2 → Ph(Cl)2P=S + H2O
应用
[编辑]用于医药、农药、染料工业及有机合成工业,作氯化剂。
因氯化亚砜可以与水强烈作用,因此它可以与金属氯化物水合盐反应,制取无水的金属氯化物。[16]
- MCln·xH2O + x SOCl2 → MCln + x SO2 + 2x HCl
氯化亚砜与过渡金属氧化物加热回流,可以得到该金属的氯氧化物:
- WO3 + 2SOCl2 → WOCl4 + 2SO2
安全和毒性
[编辑]- 侵入途径:吸入、食入、经皮吸收。
- 健康危害:吸入、口服或经皮吸收后对身体有害。对眼睛、皮肤、粘膜和呼吸道有强烈的刺激作用,可引起灼伤。吸入后可因喉、支气管的痉挛、水肿而致死。中毒表现有烧灼感、咳嗽、喘息、头晕、喉炎、气短、头痛、恶心和呕吐。
- 急性毒性:LC50 2435 mg/m3(大鼠吸入)
- 刺激性:家兔经眼:1380 µg,重度刺激。
参考材料
[编辑]- ^ M. Persoz: In: Compt. Rend. 28, 1849, S. 86–88.
- ^ P. Kremers: In: Justus Liebigs Ann. Chem. 70, 1848, S. 297–300.
- ^ Lauss, Hans-Dietrich; Steffens, Wilfried, Sulfur Halides, Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA, 2000-06-15, doi:10.1002/14356007.a25_623
- ^ N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, Pergamon Press, 1984.
- ^ Allen, C. F. H.; Byers, Jr., J. R.; Humphlett, W. J. (1963). "Oleoyl chloride". Org. Synth.; Coll. Vol. 4: 739.
- ^ Rutenberg, M. W.; Horning, E. C. (1963). "1-Methyl-3-ethyloxindole". Org. Synth.; Coll. Vol. 4: 620.
- ^ Mondanaro, K. R.; Dailey, W. P. (2004). "3-Chloro-2-(chloromethyl)-1-propene". Org. Synth.; Coll. Vol. 10: 212.
- ^ Krakowiak, K. E.; Bradshaw, J. S. (1998). "4-Benzyl-10,19-diethyl-4,10,19-triaza-1,7,13,16-tetraoxacycloheneicosane". Org. Synth.; Coll. Vol. 9: 34.
- ^ Weinreb, S. M.; Chase, C. E.; Wipf, P.; Venkatraman, S. (2004). "2-Trimethylsilylethanesulfonyl chloride (SES-Cl)". Org. Synth.; Coll. Vol. 10: 707.
- ^ Hazen, G. G.; Bollinger, F. W.; Roberts, F. E.; Russ, W. K.; Seman, J. J.; Staskiewicz, S. (1998). "4-Dodecylbenzenesulfonyl azides". Org. Synth.; Coll. Vol. 9: 400.
- ^ Hulce, M.; Mallomo, J. P.; Frye, L. L.; Kogan, T. P.; Posner, G. H. (1990). "(S)-(+)-2-(p-toluenesulfinyl)-2-cyclopentenone: Precursor for enantioselective synthesis of 3-substituted cyclopentanones". Org. Synth.; Coll. Vol. 7: 495.
- ^ Kurzer, F. (1963). "p-Toluenesulfinyl chloride". Org. Synth.; Coll. Vol. 4: 937.
- ^ Niznik, G. E.; Morrison, III, W. H.; Walborsky, H. M. (1988). "1-d-Aldehydes from organometallic reagents: 2-methylbutanal-1-d". Org. Synth.; Coll. Vol. 6: 751.
- ^ Krynitsky, J. A.; Carhart, H. W. (1963). "2-Ethylhexanonitrile". Org. Synth.; Coll. Vol. 4: 436.
- ^ 有机磷化合物.尹志刚 主编.化学工业出版社. 2.1.2.2 对卤素的置换反应. P35. (5)与光气及氯化亚砜的反应. ISBN 978-7-122-09816-0
- ^ Alfred R. Pray, Richard F. Heitmiller, Stanley Strycker. Anhydrous Metal Chlorides. Inorganic Syntheses. 1990, 28: 321–323. doi:10.1002/9780470132593.ch80.