乙酸鋰
| 乙酸鋰 | |
|---|---|
| |

| |
| 識別 | |
| CAS號 | 546-89-4(無水) 6108-17-4(二水) |
| PubChem | 11028 |
| ChemSpider | 10562 |
| SMILES |
|
| InChI |
|
| InChIKey | XIXADJRWDQXREU-REWHXWOFAX |
| EINECS | 208-914-3 |
| ChEBI | CHEBI:63045 |
| RTECS | AI545000 |
| KEGG | D08134 |
| MeSH | C488804 |
| 性質 | |
| 化學式 | C2H3LiO2 |
| 摩爾質量 | 65.99 g·mol−1 |
| 外觀 | 無色或白色晶體 |
| 密度 | 1.26 g/cm3 |
| 熔點 | 286 °C(559 K)(無水,熔化略有分解[1]) 28.3 °C(301.4 K)(二水)[2] |
| 溶解性(水) | 45.0 g/100 mL[3] |
| 磁化率 | −34.0·10−6 cm3/mol |
| 危險性 | |
| 致死量或濃度: | |
LD50(中位劑量)
|
500 mg/kg(小鼠,口服) |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
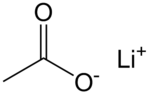
乙酸鋰是鋰的乙酸鹽,化學式為CH3COOLi。它在128 °C發生玻璃化轉變。[4]
製備[編輯]
- Li2CO3 + 2 CH3COOH → 2 CH3COOLi + H2O + CO2↑
用途[編輯]
乙酸鋰可用於製備其它鋰化合物,如磷酸鐵鋰[6]、矽酸鐵鋰(Li2FeSiO4)[7]等。
參考文獻[編輯]
- ^ CCXXI.—The solubilities of the alkali formates and acetates in water. doi:10.1039/CT9222101837
- ^ Shamberger, Patrick J.; Journal of Chemical & Engineering Data 2012, V57 (5): 1404-1411. doi:10.1021/je3000469
- ^ Lide, David R. Handbook of Chemistry and Physics 87. Boca Raton, FL: CRC Press. 1998: 465. ISBN 0-8493-0594-2.
- ^ Wang, Li-Min; Journal of Chemical Physics 2006, V125(7), P074505/1-074505/8. DOI: 10.1063/1.2244551
- ^ 乙酸鋰 (頁面存檔備份,存於互聯網檔案館). Chemical Book. [2018-3-4]
- ^ 卜立敏, 秦秀娟, 孫學亮,等. 不同鋰源對LiFePO4正極材料電化學性能的影響[J]. 有色金屬(冶煉部分), 2011(7):56-60.
- ^ 左朋建, 王濤, 程廣玉,等. Li2FeSiO4/C材料的結構和電化學性能研究[J]. 2012.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
