氯化铬
| 氯化铬 | |
|---|---|

| |
| IUPAC名 Chromium(III) chloride Chromium trichloride | |
| 别名 | 三氯化铬、氯化铬(III) |
| 识别 | |
| CAS号 | 10025-73-7 10060-12-5(六水) |
| PubChem | 6452300 |
| ChemSpider | 4954736 |
| SMILES |
|
| InChI |
|
| InChIKey | HUQISNLCWMVGCG-DFZHHIFOAJ |
| ChEBI | 53351 |
| RTECS | GB5425000 |
| 性质 | |
| 化学式 | CrCl3 |
| 摩尔质量 | 158.35 g·mol⁻¹( Cr=32.84%, Cl=67.16%) |
| 外观 | 见内文 |
| 密度 | 2.76 g/cm3(固) |
| 熔点 | 1150 °C(无水) |
| 沸点 | 1300 °C 分解 |
| 溶解性(水) | 微溶于水(无水) 58.5g/100mL(六水) |
| 结构 | |
| 晶体结构 | 三氯化钇型结构 |
| 配位几何 | 八面体 |
| 危险性 | |
| 闪点 | 不可燃 |
| 相关物质 | |
| 其他阴离子 | 氟化铬、溴化铬、碘化铬 |
| 其他阳离子 | 三氯化钼、三氯化钨 |
| 相关化学品 | 氯化亚铬、四氯化铬 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
氯化铬(化学式:CrCl3)也称三氯化铬、氯化铬(III),是常见的铬(III)化合物之一。有无水物和六水合物两种。
物理性质及结构
无水物为强烈发光的紫色结晶,几乎不溶于水。六水物 是一个配合物,有三种水合异构体:,分别为紫色、浅绿色和暗绿色的固体。一般买到的都是暗绿色的异构体。
三氯化铬晶体中含有连接成层的 CrCl6 八面体单元,结构中存在螺旋状位错,不含有金属-金属键。它与三碘化铬同构。
化学性质
氯化铬是较硬的路易斯酸。其中含 d3 构型的三价铬,对于配体置换反应来说是惰性的。为了提高其活性,可以加入少量的还原剂(如锌 / 盐酸),将其还原为氯化亚铬,很快发生配体交换反应,然后使其与 CrCl3 通过氯桥发生电子转移,获得三价铬的配合物,并再生成少量活性的Cr(II),直至所有Cr(III)都发生了取代反应。
无水三氯化铬几乎不溶于水,但在还原剂(如锌)存在时会缓慢溶解,原因可能是生成了电荷转移的桥连配合物 [Cr2+-X-Cr3+…X]。溶解的产物是紫色的 [Cr(H2O)6]3+ 离子。如果配体是吡啶,则产物是 [CrCl3(C5H5N)3]。Cr(III)的配位数为6的配合物大多都是八面体型的。
与碱金属氯化物(如氯化钾)熔融时,三氯化铬生成含八面体型 [CrCl6]3− 离子,以及多聚生成的 Cr2Cl93− 等离子的盐类。
制备
无水三氯化铬可通过单质高温化合制备。或者800°C时,用三氧化二铬与氯气在碳存在下反应也可以得到无水三氯化铬。[1]
六水合三氯化铬在650°C时与四氯化碳蒸汽反应,可以得到不含 CrOCl 的无水三氯化铬。也可以用亚硫酰氯脱水。
水合三氯化铬可由金属铬与盐酸反应得到。
用途
无水三氯化铬是有机金属化学中的重要原料。以它为原料可以制得很多有机铬化合物,比如结构上与二茂铁类似的二苯铬(下图)。三氯化铬也是很多铬(III)配合物的起始原料。
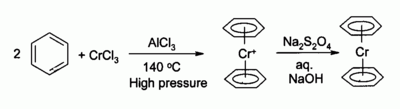
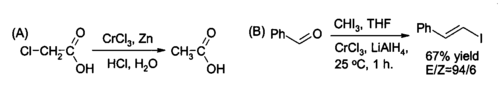
有机合成中,CrCl3 被原位还原生成的 CrCl2 是常用的有机还原试剂之一。它可以(A)将 C-Cl 键还原为 C-H 键,也可以(B)与醛作用,将其还原为烯基卤化物。第二个还原反应中通常用2:1摩尔比的三氯化铬和氢化铝锂。
三氯化铬的路易斯酸性可以用于催化某些反应,例如用亚硝基化合物作亲双烯体的狄尔斯-阿尔德反应。[2]
脚注
- ^ D. Nicholls, Complexes and First-Row Transition Elements, Macmillan Press, London, 1973.
- ^ Calvet, G.; Dussaussois, M.; Blanchard, N.; Kouklovsky, C. Lewis Acid-Promoted Hetero Diels-Alder Cycloaddition of α-Acetoxynitroso Dienophiles. Organic Letters. 2004, 6: 2449–2451. doi:10.1021/ol0491336.
参考资料
- N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, 2nd ed., Butterworth-Heinemann, Oxford, UK, 1997.
- Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- The Merck Index, 7th edition, Merck & Co, Rahway, New Jersey, USA, 1960.
- A. F. Wells, Structural Inorganic Chemistry, 5th ed., Oxford University Press, Oxford, UK, 1984.
- J. March, Advanced Organic Chemistry, 4th ed., p. 723, Wiley, New York, 1992.
- K. Takai, in Handbook of Reagents for Organic Synthesis, Volume 1: Reagents, Auxiliaries and Catalysts for C-C Bond Formation, (R. M. Coates, S. E. Denmark, eds.), pp. 206-211, Wiley, New York, 1999.


![{\displaystyle {\rm {[Cr(H_{2}O)_{6}]Cl_{3},[Cr(H_{2}O)_{5}Cl]\!\cdot \!Cl_{2}\!\cdot \!H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a84aac13dec557b1220ec14bd279bf08916fa38)
![{\displaystyle {\rm {,[Cr(H_{2}O)_{4}Cl_{2}]Cl\!\cdot \!2H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5dbee9d6a05947d858ced186e707055fac0a1679)
![{\displaystyle {\rm {CrCl_{3}+3C_{5}H_{5}N\rightarrow [CrCl_{3}(C_{5}H_{5}N)_{3}]\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8c306b3ece0f20c8e67482993ab8846eb9318fdc)
