主动脉夹层
| 主动脉剝離 | |
|---|---|
 | |
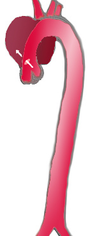
| 降主动脉(从左锁骨下动脉到腹主动脉(4))夹层(3),没有牵涉到升主动脉(1)和主动脉弓(2) | |
| 症状 | 胸背劇痛、嘔吐、冒汗、頭重腳輕[1][2] |
| 併發症 | 中風、腸繫膜缺血、冠狀動脈疾病、主動脈破裂[2] |
| 起病年龄 | 突發性[1][2] |
| 类型 | 剝離[*]、aortic disease[*]、急性主動脈症候群[*]、疾病 |
| 风险因素 | 高血壓、馬凡氏症候群、二葉式主動脈瓣、曾接受心臟手術、重大創傷、吸煙[1][2][3] |
| 診斷方法 | 醫學影像[1] |
| 預防 | 血壓控制、戒菸 [1] |
| 治療 | 依不同分型而定[1] |
| 预后 | 未治療死亡率 10%(B型)、50%(A型)[3] |
| 患病率 | 每年每100,000人中有3人[3] |
| 分类和外部资源 | |
| 醫學專科 | 血管外科、胸腔外科學 |
| ICD-10 | I71.0 |
| OMIM | 607086 |
| DiseasesDB | 805 |
| MedlinePlus | 000181 |
| eMedicine | 756835 |
主動脈剝離(英語:Aortic dissection;法語:Dissection aortique;德語:Aortendissektion),又譯為主动脉剥离或心血管動脈撕裂,是因為主動脈血管內膜受傷,使得血液可以流入主動脈壁各層之間,使血管層剝離的症狀[3]。大部份的情形下,在主動脈剝離時會有嚴重、撕裂状的胸痛或是背痛[1][2],同時會有嘔吐、冒汗、頭重腳輕等症狀[2]。因為無法提供足夠血液到其他器官,也會有像中風或腸繫膜缺血等症狀[2]。主動脈剝離後,因為無法提供心臟足夠的血液或是主動脈破裂,可能很快會致命[2]。
主動脈剝離較常出現在有高血壓及主動脈瓣二葉畸形患者。或是患有馬凡氏症候群等會影響血管強度的疾病,以及曾接受過心臟手術的人[2][3]。重傷、吸烟、使用可卡因、懷孕、主動脈瘤、動脈炎、血脂異常也會提高高動脈剝離的風險[1][2]。初始的診斷會以X射线计算机断层成像、核磁共振成像、等醫學影像為基礎,之後再進一步的評估主動脈剝離的情形[1]。主動脈剝離可根據是否影響升主動脈而分為Stanford A型(影響升主動脈)及Stanford B型(不影響升主動脈)[1]。
主動脈剝離的預防方式包括控制血壓及戒菸[1]。其治療方式和主動脈剝離的部位有關[1],若是和升主動脈有關,一般要進行手術。其他型的主動脈剝離,只要沒有其他的併發症,一般會用血壓控制以及降低心率來治療[1][2]。手術可以用胸腔手術來進行,也可以用血管內進行的血管腔內主動脈瘤修復來治療[1]。
主动脉剝離相對罕见,发生率約為每年10万人有3人[1][3],其中男性比女性更常见[1]。典型的诊断年龄是63岁,约有10%的病例发生在40岁以前[1][3]。如果不进行治疗,约一半的Stanford A型病人会在三天内死亡,约10%的Stanford B型病人会在一个月内死亡[3]。歷史上描述的第一例主动脉剝離病例是在1760年英国国王乔治二世去世后的驗屍報告[3],Michael E. DeBakey在1950年引入了主动脉剝離手术[3]。
分型
目前对主动脉夹层有几种不同的分型方法。临床上应用的比较多的是DeBakey分型和Stanford分型。
DeBakey分型
DeBakey分型以美国外科医生、主动脉夹层患者Michael E. DeBakey命名。它分型的依据是主动脉夹层撕裂的位置和夹层扩展的情况[4]。

|
|

| |
| 发生率 | 60% | 10–15% | 25–30% |
| 分型 | DeBakey I | DeBakey II | DeBakey III |
| Stanford A | Stanford B | ||
| 近端累及 | 远端累及 | ||
| 主动脉夹层分型 | |||
- I型——胸主动脉夹层起源于升主动脉并向远端延伸,至少累及主动脉弓;
- II型——胸主动脉夹层起源并局限于升主动脉;
- III型——胸主动脉夹层起源于降主动脉,很少向近端延伸,但可能会累及血管远端。其中向下未累及腹主动脉的称为称为IIIA型,累及腹主动脉的称为IIIB型。
Stanford分型
Stanford分型将主动脉夹层分为A、B两型,分型的依据是是否累及升主动脉[5]。
- A型——主动脉夹层涉及升主动脉和/或主动脉弓,降主动脉也有可能累及。内膜撕裂起源于升主动脉,主动脉弓,或者降主动脉(比较少见)[6]。此分型相当于DeBakey I型、DeBakey II型和逆行DeBakey III型[7] (主动脉夹层起源于降主动脉并向近端延伸,累及到升主动脉);
- B型——主动脉夹层涉及降主动脉和/或延伸至腹主动脉,但不累及升主动脉和主动脉弓[6]。此分型相当于DeBakey III型未逆行累及升主动脉的病例。
Stanford分型在临床实践中比较实用,其中A型夹层一般主张进行手术修复,而B型夹层以初步支持治疗为主,外科手术仅是作为并发症发生时才予使用的手段[8]。
症状和体征
约有96%主动脉夹层患者有突然发作的剧烈撕裂性疼痛,这是为本病最突出且有特征性的症状。由于主动脉壁撕裂沿着血管壁延伸,17%的患者会感觉到迁移性疼痛[9]。疼痛的位置和撕裂的位置密切相关。如前胸痛提示撕裂处可能在升主动脉,而后背痛和降主动脉夹层密切相关。如果出现类似胸膜炎的疼痛,可能提示升主动脉夹层出现外破口,血液进行心包腔而引起的急性心包炎。这是一种极其凶险的事件,表明可能发生急性心包填塞。主动脉夹层的疼痛症状可能会和心肌梗死(心脏病发作)的疼痛相混淆,但主动脉夹层通常并不伴有心脏衰竭的其他体征(包括心脏衰竭等)和心电图变化。此外,主动脉夹层患者通常没有出汗的体征。慢性主动脉夹层患者可能不会出现疼痛。
主动脉夹层比较少见的症状和体征包括:充血性心力衰竭(7%),晕厥(9%),脑血管意外(3-6%),缺血性周围神经病变,瘫痪,心脏骤停,猝死。如果个人有晕厥发作,有一半可能是因为主动脉夹层出现外破口血液进入心包引起心包填塞。主动脉夹层的神经系统并发症(即脑血管意外及瘫痪)是由于供应中枢神经系统的一个或多个动脉被主动脉夹层累及所致。如果主动脉夹层累及腹主动脉,3-5%的腹主动脉夹层患者会扩展到肠系膜动脉可致肠坏死急腹症,而5–8%的病例扩展到肾动脉可引起急性腰痛、血尿、急性肾衰竭或肾性高血压。
血压
虽然大部分主动脉夹层患者都有高血压病史,血压值在急性主动脉夹层的表现是相当多变的,往往是主动脉夹层远端剥离的患者血压会更高一些。主动脉夹层近端剥离的患者,36%出现高血压,而25%出现低血压体征。而在主动脉夹层远端剥离的患者中,70%出现高血压,而4%出现低血压体征。
严重低血压体征往往预示患者的预后非常不好,它通常是与心包填塞,严重的主动脉瓣关闭不全,或主动脉破裂密切相关。准确测量血压非常重要。如果头臂动脉(供应右臂)或左锁骨下动脉(供应左臂)被主动脉夹层累及,可能出现假性低血压的情况。
主动脉瓣关闭不全
有一半到三分之二的升主动脉夹层患者会出现主动脉瓣关闭不全。而在近端撕裂患者中,32%可以在听诊时听到主动脉瓣关闭不全的杂音。杂音的强度(即响度)依赖于患者血压的高低,在低血压时可能为无声。
升主动脉夹层患者出现主动脉瓣关闭不全有多种病因。一是剥离可能是主动脉瓣环扩张,主动脉瓣叶不能完全结合导致关闭不全。另一种机制是夹层可能延伸到主动脉根部并导致主动脉瓣叶分离。第三个原因是,如果出现广泛的内膜撕裂,内膜瓣可能脱垂进入左心室流出道,造成主动脉内膜套叠导致主动脉瓣叶关闭不全。
心肌梗死
有1-2%的主动脉夹层患者会发生心肌梗死(心脏病发作)。心肌梗死的病因是供应心脏的冠状动脉被病变累及。右冠状动脉比左冠状动脉更容易受到主动脉夹层累及。如果这时错误使用溶栓疗法治疗心肌梗死,死亡率将增加70%以上,这主要是由于出血进入心包腔导致心脏压塞。
胸腔积液
血液从主动脉外破口进入胸腔或主动脉周围出现炎症反应都可以导致胸腔积液。如果胸腔积液是由于主动脉夹层破裂导致的,那么胸腔积液更有可能出现在左侧胸廓。
病因
主动脉夹层和高血压以及许多结缔组织疾病密切相关,而动脉炎则很少引起主动脉夹层。主动脉夹层也可能是胸部创伤的结果。 72至80%的主动脉夹层患者有高血压史。 主动脉夹层在50至70岁的人中发病率最高。男性的发病率是女性的两倍。小于40岁的女性主动脉夹层患者中有一半是发生在怀孕期间(通常是在第三孕期或产后早期)。
7-14%的主动脉夹层患者可以发现存在先天性主动脉瓣二叶畸形,夹层主要发生于升主动脉段。先天性主动脉瓣二叶畸形的人发生主动脉夹层的危险和动脉瓣的狭窄程度不相关。
5-9%的主动脉夹层患者是马凡氏综合征病人,这些人更容易在年轻时发病。马凡氏综合征的患者更容易出现主动脉瘤和主动脉近端夹层。
特纳综合征可以导致主动脉根部扩张,从而增加发生主动脉夹层的风险[10]。
胸部外伤导致主动脉夹层的发生根据病因可分为两类:一是钝性胸部创伤(常见于车祸);另一种是医源性。医源性原因包括心脏导管插入术或主动脉内球囊反搏泵引起的创伤。
主动脉夹层也可能是心脏手术的晚期后遗症。18%的急性主动脉夹层患者有开放性心脏手术史。主动脉瓣置换术治疗主动脉瓣关闭不全的个人发生主动脉夹层的风险非常高,这时因为主动脉瓣关闭不全可以导致升主动脉血流增加,从而导致升主动脉壁的扩张和脆弱。
病理生理学

和所有其他动脉相同,主动脉也是由外膜层,中间层和内膜层三层构成。内膜位于血管最里面,和流动的血液直接接触,主要由内皮细胞构成。中间一层是中间层,由平滑肌细胞和弹力纤维的混合组成,又被称为肌层。最外面是外膜层,由结缔组织组成。
如果血液穿过内膜层进入中间层,即形成主动脉夹层。内膜可以沿着血管壁向近端或向远端撕裂。向髂总动脉分叉处 方向(和血流方向相同)的撕裂称为顺行性夹层,向主动脉根部方向(和血流方向相反)的撕裂称为逆行性夹层。主动脉夹层最初的撕裂位置通常是在距离主动脉瓣100毫米内的主动脉壁上,因此逆行性夹层容易引起出血进入心包腔内。顺行性夹层可以沿着血管壁进展一直到达髂总动脉分叉处,使血管壁撕裂,或者重建一个新的血管管腔,出现双桶状的主动脉。双桶状的主动脉降低血流量的压力,降低血管破裂的危险。破裂会导致出血进入体腔,而预后则取决于破裂的面积。腹膜和心包破裂都是可能的。
主动脉夹层的起始事件是主动脉内膜的撕裂。由于主动脉内的高压力,血液进入撕裂处血管壁的中间层。血液进入血管壁中间层的力量导致撕裂延伸。它可以向近端(靠近心脏)延伸或向远端(远离心脏)延伸,也可以向两端延伸。血液在中间层流动,创造出一个假腔(真腔是血液在主动脉流动的正常渠道)。假腔和真腔的分隔是内膜,这个组织被称为内膜瓣。
绝大多数主动脉夹层起源于升主动脉(65%)。其他起源包括主动脉弓(10%),或者胸降主动脉动脉韧带远侧(20%)等。
沿着假腔流动的血液,可能会使内膜二度撕裂,通过这些二次撕裂口,血液可以重新进入真腔。
虽然目前对内膜撕裂的发生机理暂时不确定,但往往涉及到组成中间层的胶原蛋白和弹性纤维变性,这被称为囊性中层坏死。囊性中层坏死和马凡氏综合征有密切的关联,也和Ehlers - Danlos综合征密切相关。
约13%的主动脉夹层患者没有内膜撕裂的直接证据。据认为,这些情况下是由中间层出血导致血管壁内血肿引起的。这些病例真腔和假腔没有直接联系,如果病因是壁内血肿,很难通过主动脉造影来对主动脉夹层进行诊断。血管壁内血肿导致主动脉夹层应该和内膜撕裂导致主动脉夹层同等对待。
诊断
由于主动脉夹层的症状和体征取决于主动脉夹层内膜撕裂和剥离的程度,有时难以作出正确的诊断。
虽然详细的病史可能可以强烈支持主动脉夹层的存在,但诊断往往并不能单靠病史和体征。诊断通常是靠内膜瓣上可视化的影像学检查来判断。主动脉夹层常见的影像学检查包括应用含碘造影剂对胸部进行CT检查,以及经食管超声心动图检查。其他可用的检查包括:主动脉造影片、主动脉的磁共振血管造影(MRA)。这些检查都有其特有的优点和缺点,在主动脉夹层诊断中各自的敏感性和特异性都不同。
在一般情况下,所采用的成像技术主要基于成像检查前的诊断,测试方式的可行性,患者的稳定性以及检查的敏感性和特异性来选择的。
D-二聚体
血液D-二聚体水平低于500ng/mL的可能可以排除主动脉夹层的诊断,减少进一步影像学检查的需要[12]。
胸部X光平片

胸部X光平片见上纵隔影扩大,对诊断主动脉夹层具有中等程度的敏感性(67%)[13],但特异性较低,很多其他情况都可以在胸部X光检查看到纵隔扩大的征象。
在胸部X光片看到钙化影是判断主动脉夹层的一个指征。钙化是内膜和主动脉外软组织的分离的征象,增到10mm时提示夹层分离的可能,若超过10mm则可肯定为主动脉夹层。
胸部X光片上还可能会看到胸腔积液。他们在降主动脉夹层中更常见,通常出现左胸廓。其他的发现包括主动脉结闭塞,左主支气管压迫,气管条纹减少或消失以及气管偏位。
大约12%至20%的主动脉夹层患者胸部X光检查检查正常,因此正常的胸部X光片并不能排除主动脉夹层的可能。如果临床特征高度怀疑是主动脉夹层,当务之急是使用其他影像学检查(CT血管造影,MRA,主动脉造影,或经食道心脏超声检查)予以排除。
CT检查

CT血管造影是一种快速非侵入性的检查,将会提供一个准确的主动脉三维图。CT检查是对胸部和腹部进行快速的断层扫描,并由计算机相结合制作出横截面切片。通过外周静脉注入碘造影剂可以勾画出主动脉的轮廓,使主动脉夹层诊断的准确性增加。在造影剂注射后,使用对比剂自动跟踪技术(Bolus Tracking)进行扫描。这是一种延时扫描技术,直到造影剂流入主动脉时才开始扫描。
CT检查的敏感性和特异性都很高,都高达96至100%。它的缺点包括需要碘造影剂,不能确诊内膜撕裂的部位等。
MRI
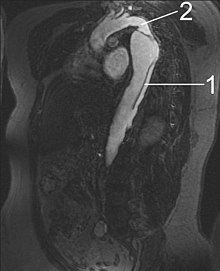
1 降主动脉夹层
2 主动脉峡
磁共振成像(MRI)是目前主动脉夹层检查和评估的金标准,有高达98%的敏感性和高达98%的特异性。主动脉的MRI检查将会提供一个三维重建的主动脉,让医生来判断内膜撕裂的位置,分支血管的累及,并找到继发性撕裂的位置。它是一种非侵入性的检查,而且不需要使用碘造影剂材料,同时还可以检测并定量分析主动脉瓣关闭不全的程度。
磁共振成像扫描检查主动脉夹层的缺点是可行性较低,往往只有在大医院才拥有磁共振成像设备,而且扫描比较费时。由于MRI检查过程中存在高强度的磁场,带有金属植入物如装有起搏器、人工关节等的患者禁止使用这种检查。另外,有一些人在MRI扫描设备中会出现幽闭恐惧症。
经食管超声心动图

经食管超声心动图(TEE)是一个比较好的诊断主动脉夹层的检查,具有98%的敏感性和97%的特异性。这是一个相对的非侵入性检查,因为检查中要求患者经食道吞入超声心动图探头。这种检查对升主动脉夹层具有非常好的效果,并可以确定冠状动脉的开口是否被主动脉夹层累及。许多医疗机构为增加患者的舒适度,在经食管超声心动图检查时会提供镇静剂,不过如果患者配合检查,也可以不用使用镇静剂。
经食管超声心动图的缺点包括无法获得远端主动脉(主动脉弓开始)和位于胃下方的腹主动脉的影像。食管狭窄或食管静脉曲张的患者在技术上难以使用经食管超声心动图进行检查。
主动脉造影
主动脉造影需要在进行胸部X线照影在主动脉安置导管并注射造影剂,这个过程称为主动脉造影法。在过去被认为是主动脉夹层诊断的金标准。但由于这种检查是有创性的,现在已经被其他侵入性小的影像学检查所取代。
治疗
急性主动脉夹层的治疗方案取决于撕裂的位置。Stanford A型主动脉夹层(升主动脉撕裂),手术治疗要优于药物治疗。而对没有并发症的Stanford B型主动脉夹层(远端主动脉,腹主动脉夹层撕裂),药物治疗要先于手术治疗[14]。
主动脉夹层在发生后的最初几个小时死亡率最高,然后开始下降。因此,急性主动脉夹层和慢性夹层的治疗策略不同。急性主动脉夹层的发病时间在两个星期内,如果患者能成功度过这个时期,他们的预后将比较好。约有66%的主动脉夹层出现急性期。发病时间超过两个星期的称为慢性主动脉夹层。这些人是急性主动脉夹层发作的存活者,比较稳定,可以进行长期的药物治疗。
药物治疗
主动脉夹层一般表现为高血压急症,因此内科治疗首要考虑的因素是要严格控制血压。血压控制的目标是平均动脉压控制在60至75毫米汞柱,或是病人能耐受的最低血压。另一个因素是减少左心室dp/dt的剪切力(左心室向升主动脉射血的力量)。
β受体阻滞剂是治疗急性和慢性主动脉夹层的一线药物。急性主动脉夹层的病人,迅速给予静脉药物(如艾司洛尔,普萘洛尔,拉贝洛尔等)是首选。血管扩张剂,如硝普钠,可以用于持续的高血压患者,但这类药物不应该单独使用,因为它们通常会导致反射性心动过速。
钙通道阻滞剂也可用于治疗主动脉夹层,特别是如果存在β受体阻滞剂的禁忌症。最常用的钙通道阻滞剂是维拉帕米和地尔硫卓,因为他们有血管扩张及减弱肌肉的联合作用。
如果个别顽固性高血压(使用三种不同类别最大剂量的降压药进行治疗后依然存在持续性高血压),必须考虑主动脉夹层累及肾动脉导致肾性高血压的问题。
手术治疗
主动脉夹层手术治疗的适应症包括急性近端主动脉夹层(A型主动脉夹层)或急性远端主动脉夹层合并一个或多个并发症,这些并发症包括累及重要器官、主动脉破裂或即将破裂、夹层逆撕至升主动脉以及有马凡氏综合征或Ehlers–Danlos综合征的病史等。
主动脉夹层手术治疗的目的是切除破坏最严重的主动脉段,阻止血液进入假腔(包括主动脉的原始撕裂口以及后续的撕裂段)[15][16][17]。虽然也可以进行撕裂内膜的切除术,但这并不会显著改变死亡率。
主动脉夹层的修复方法有:
- 当主动脉瓣没有损害时可以将植入导管(通常由涤纶制成),替代受损的主动脉段。
- Bentall手术:更换受损的主动脉和主动脉瓣替换术。
- David手术:更换受损的主动脉和主动脉瓣再植术。
- 在受损主动脉段插入一个覆膜支架,如:在胸主动脉腔内修复(thoracic endovascular aortic repair,TEVAR)使用。它通常是和正在进行的药物治疗一起使用。
- 和一个和血管环吻合的涤纶移植物更换损坏的主动脉段[18]。
有些条件会增加主动脉夹层修复的手术风险。这些条件包括:
- 术前检查及评估时间过长;
- 高龄;
- 伴发疾病(如:冠状动脉疾病);
- 动脉瘤渗漏;
- 心包填塞;
- 中风;
- 过去有心肌梗死或脑血管意外的病史;
- 过去有肾功能衰竭(急性或慢性肾功能衰竭)的病史。
随访
主动脉夹层患者的长期随访包括严格的血压控制。在未控制的高血压主动脉夹层患者中,后期出现主动脉瘤破裂的相对危险度是收缩压低于130毫米汞柱的患者的10倍。
主动脉夹层急性期过后最初两年,死亡的风险是最大的,这是需要对病人进行密切的随访。29%的手术后患者因夹层动脉瘤或其他动脉瘤破裂而死亡。此外,还有17%至25%由于新的动脉瘤形成而发病。这通常是由于手术残留的假腔扩张引起的。由于这些新形成的动脉瘤位于血管壁薄弱的地方,更容易出现破裂。
建议随访时进行主动脉串行成像检查,磁共振成像(MRI)是首选的成像技术。
预后
| 25% | 发病后24小时内死亡 |
| 50% | 发病后72小时内死亡 |
| 80% | 发病后2週内死亡 |
| 90% | 发病后1個月内死亡 |
未经治疗的主动脉夹层死亡风险很高。在疾病发作的第一个24小时有非常高的死亡风险,但即使生存下来,其死亡率依然比年龄和性别匹配的对照组高。75%未得到治疗的升主动脉夹层患者在2个星期内死亡。经过积极治疗的胸主动脉夹层患者30天生存率为90%[19]。
参考文献
- ^ 1.00 1.01 1.02 1.03 1.04 1.05 1.06 1.07 1.08 1.09 1.10 1.11 1.12 1.13 1.14 1.15 1.16 Nienaber, CA; Clough, RE. Management of acute aortic dissection.. Lancet. 28 February 2015, 385 (9970): 800–11. PMID 25662791. doi:10.1016/s0140-6736(14)61005-9.
- ^ 2.00 2.01 2.02 2.03 2.04 2.05 2.06 2.07 2.08 2.09 2.10 White, A; Broder, J; Mando-Vandrick, J; Wendell, J; Crowe, J. Acute aortic emergencies--part 2: aortic dissections.. Advanced emergency nursing journal. 2013, 35 (1): 28–52. PMID 23364404. doi:10.1097/tme.0b013e31827145d0.
- ^ 3.00 3.01 3.02 3.03 3.04 3.05 3.06 3.07 3.08 3.09 3.10 Criado FJ. Aortic dissection: a 250-year perspective. Tex Heart Inst J. 2011, 38 (6): 694–700. PMC 3233335
 . PMID 22199439.
. PMID 22199439.
- ^ DeBakey ME, Henly WS, Cooley DA, Morris GC Jr, Crawford ES, Beall AC Jr. Surgical management of dissecting aneurysms of the aorta. J Thorac Cardiovasc Surg. Jan 1965, 49: 130–49. PMID 14261867.
- ^ Daily PO, Trueblood HW, Stinson EB, Wuerflein RD, Shumway NE. Managementof acute aortic dissections. Ann Thorac Surg. Sep 1970, 10 (3): 237–47. PMID 5458238. doi:10.1016/S0003-4975(10)65594-4.
- ^ 6.0 6.1 University of Ottawa: Meds 2008 > Surgery Objectives (PDF). [2011-08-15]. (原始内容 (PDF)存档于2011-08-21).
- ^ Antero-Lateral Thoracotomy with Partial Sternotomy for Retrograde DeBakey III Type Closing Aortic Dissection (页面存档备份,存于互联网档案馆) Accession number;06A0069173 Author;SUESHIRO MASAFUMI, HAYASHI SAIHO, KOBAYASHI HIRONORI Journal Title;Japanese Journal of Cardiovascular Surgery Journal Code:Y0192A ISSN:0285-1474 VOL.35;NO.1;PAGE.21-24(2006)
- ^ von Segesser LK; Killer I; Ziswiler M; et al. Dissection of the descending thoracic aorta extending into the ascending aorta. A therapeutic challenge. J. Thorac. Cardiovasc. Surg. October 1994, 108 (4): 755–61 [2011-08-15]. PMID 7934113. (原始内容存档于2012-10-30).
- ^ Slater, E.; DeSanctis, RW. The clinical recognition of dissecting aortic aneurysm. The American Journal of Medicine. 1976, 60 (5): 625–33. PMID 1020750. doi:10.1016/0002-9343(76)90496-4.
- ^ Practice Committee of the American Society for Reproductive Medicine. Increased maternal cardiovascular mortality associated with pregnancy in women with Turner syndrome. Fertil Steril. Nov 2006, 86 (5 Suppl): S127–8. PMID 17055808. doi:10.1016/j.fertnstert.2006.08.082.
- ^ Kamalakannan D, Rosman HS, Eagle KA. Acute aortic dissection. Crit Care Clin. October 2007, 23 (4): 779–800, vi. PMID 17964363. doi:10.1016/j.ccc.2007.07.002.
- ^ Shimony, A; Filion; KB; Mottillo; S; Dourian; T; Eisenberg; MJ. Meta-analysis of usefulness of d-dimer to diagnose acute aortic dissection.. The American journal of cardiology. 15 Apr 2011, 107 (8): 1227–34. PMID 21296332.
- ^ von Kodolitsch Y, Nienaber C, Dieckmann C, Schwartz A, Hofmann T, Brekenfeld C, Nicolas V, Berger J, Meinertz T. Chest radiography for the diagnosis of acute aortic syndrome. Am J Med. 2004, 116 (2): 73–7. PMID 14715319. doi:10.1016/j.amjmed.2003.08.030.
- ^ Suzuki T, Mehta RR, Ince H, Nagai R, Sakomura Y, Weber F, Sumiyoshi T, Bossone E, Trimarchi S, Cooper J, Smith D, Isselbacher E, Eagle K, Nienaber C. Clinical profiles and outcomes of acute type B aortic dissection in the current era: lessons from the International Registry of Aortic Dissection (IRAD). Circulation. 2003, 108 (Suppl 1): II312–7. PMID 12970252. doi:10.1161/01.cir.0000087386.07204.09.
- ^ Nazari S, Salvi S, Aluffi A, Visconti E, Rescigno G, Buniva P. Prosthesis for aortic arch substitution. Ann Thorac Surg. Nov 1997, 64 (5): 1339–44. PMID 9386701. doi:10.1016/S0003-4975(97)00991-0.
- ^ Aluffi A, Berti A, Buniva P, Rescigno G, Nazari S. Improved device for sutureless aortic anastomosis applied in a case of cancer. Tex Heart Inst J. 2002, 29 (1): 56–9. PMC 101273
 . PMID 11995854.
. PMID 11995854.
- ^ Stefano Nazari: Expandable device type III for easy and reliable approximation of dissection layers in sutureless aortic anastomosis. Ex vivo experimental study. Interact CardioVasc Thorac Surg 2010;10:161-164. doi:10.1510/icvts.2009.216291
- ^ Jeng Wei, Chung-Yi Chang, Yi-Cheng Chuang, Sung-Hou Sue, Kuo-Chen Lee, David Tung (2009): A new vascular ring connector in surgery for aortic dissection. The Journal of Thoracic and Cardiovascular Surgery. 138: 674-7
- ^ Woo KM, Schneider JI. High-risk chief complaints I: chest pain--the big three. Emerg. Med. Clin. North Am. November 2009, 27 (4): 685–712, x. PMID 19932401. doi:10.1016/j.emc.2009.07.007.
