镧系元素
| 原子序数 | 名称 | 符号 |
|---|---|---|
| 57 | 镧 | La |
| 58 | 铈 | Ce |
| 59 | 镨 | Pr |
| 60 | 钕 | Nd |
| 61 | 钷 | Pm |
| 62 | 钐 | Sm |
| 63 | 铕 | Eu |
| 64 | 钆 | Gd |
| 65 | 铽 | Tb |
| 66 | 镝 | Dy |
| 67 | 钬 | Ho |
| 68 | 铒 | Er |
| 69 | 铥 | Tm |
| 70 | 镱 | Yb |
| 71 | 镥 | Lu |
鑭系元素是第57号元素镧到71号元素镥(或称镏)共15种元素的统称。镧系元素也属于过渡元素,只是镧系元素的外层和次外层的电子构型基本相同,新增加的电子則大都填入从外侧数第三个电子层(即4f电子层)中,所以镧系元素又可以称为4f系。为了区别于元素周期表中的d区过渡元素,故又将镧系元素及锕系元素合称为内过渡元素。由于镧系元素都是金属,所以又可以和锕系元素统称为f区金属。镧系元素用符号Ln表示。
鑭系元素和鈧、釔兩元素合稱為稀土元素,它們彼此之間具有相似的化學性質,難以相互分離,再加上它們在地殼中的分布相當分散,因而造成開採上的困難。不過所有镧系元素既能生成化学性质类似的三价化合物,个别镧系元素也能生成比较稳定或不很稳定的四价或二价化合物,所以15个鑭系元素之間的化学性质并不完全相似,在光学、电磁学等物理性质也有较大的差别,此外鑭系收縮現象也增加鑭系元素彼此之間化學性質的相異性。
性質
| 元素名稱 | 鑭 | 鈰 | 鐠 | 釹 | 鉕 | 釤 | 銪 | 釓 | 鋱 | 鏑 | 鈥 | 鉺 | 銩 | 鐿 | 鎦 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 原子序 | 57 | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 | 71 |
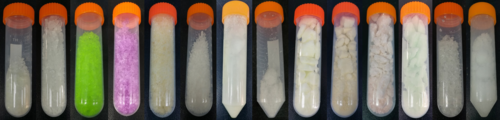
| 圖片 |  |
 |
 |
 |
|||||||||||
| 密度(g/cm3) | 6.162 | 6.770 | 6.77 | 7.01 | 7.26 | 7.52 | 5.244 | 7.90 | 8.23 | 8.540 | 8.79 | 9.066 | 9.32 | 6.90 | 9.841 |
| 熔點(°C) | 920 | 795 | 935 | 1024 | 1042 | 1072 | 826 | 1312 | 1356 | 1407 | 1461 | 1529 | 1545 | 824 | 1652 |
| 沸點(°C) | 3464 | 3443 | 3520 | 3074 | 3000 | 1794 | 1529 | 3273 | 3230 | 2567 | 2720 | 2868 | 1950 | 1196 | 3402 |
| 電子組態 (氣相) |
5d1 | 4f15d1 | 4f3 | 4f4 | 4f5 | 4f6 | 4f7 | 4f75d1 | 4f9 | 4f10 | 4f11 | 4f12 | 4f13 | 4f14 | 4f145d1 |
| 電子組態 (固相) |
5d1 | 4f15d1 | 4f25d1 | 4f35d1 | 4f45d1 | 4f55d1 | 4f7 | 4f75d1 | 4f85d1 | 4f95d1 | 4f105d1 | 4f115d1 | 4f125d1 | 4f14 | 4f145d1 |
| 金屬半徑(pm) | 162 | 181.8 | 182.4 | 181.4 | 183.4 | 180.4 | 208.4 | 180.4 | 177.3 | 178.1 | 176.2 | 176.1 | 175.9 | 193.3 | 173.8 |
| 25°C時的電阻率(μΩ·cm) | 57–80 20 °C |
73 | 68 | 64 | 88 | 90 | 134 | 114 | 57 | 87 | 87 | 79 | 29 | 79 | |
| 磁化率 χmol /10−6(cm3·mol−1) |
+95.9 | +2500(β) | +5530(α) | +5930(α) | +1278(α) | +30900 | +185000 (350 K) |
+170000 (α) | +98000 | +72900 | +48000 | +24700 | +67(β) | +183 |
鑭系元素皆為银灰色有光泽的金屬,晶体结构多为六方最密堆積(HCP)或面心立方(FCC)。鑭系元素的性质较软,彼此之間具有相似的化学性质,在潮湿空气中不易保存,易溶于稀酸。原子价主要是+3价(铈正四价较稳定,镨和铽也有极个别的四价氧化物,钐、铕、镱有二价化合物),能形成稳定的配合物及微溶于水的草酸盐、氟化物、碳酸盐、磷酸盐及氢氧化物等。
在鑭系元素的三价氧化物中,氧化镧的吸水性和碱性与氧化钙相似,其余则依次转弱。三价鑭系元素的化学性质彼此都很相似,所以難以將它們相互分離。
鑭系元素具有顺磁性(鑭的化合物除外),而鑭的化合物則呈反磁性。
鉕是唯一一個沒有穩定同位素的鑭系元素,其寿命最长的同位素145Pm的半衰期為17.7年,会衰变成接近稳定的145Nd,再衰变成141Ce,最后衰变成稳定的141Pr。
争论
镥(Lu)是否属于镧系元素有争论。但为了方便叙述,现今仍习惯将其与镧系合称。参见锕系元素中关于铹的地位的争论。
氧化态
镧系元素在固态、水溶液中或其他溶剂中的特征氧化态是+3。由于镧系元素在气态时,失去两个6s电子和一个5d电子或失去两个6s电子和一个4f电子所需的电离能比较低,所以一般能形成稳定的+3氧化态。除+3特征氧化态外,镧系元素还存在着一些不常见的氧化态。例如:铈、镨、钕、铽、镝存在+4氧化态,原因是它们的4f层保持或接近全空、半满或全充满的状态比较稳定,但只有+4氧化态的铈能存在于溶液中,它是很强的氧化剂。
原子半径和离子半径(镧系收缩)
与同族的钪、钇、镧原子半径逐渐增大的规律恰恰相反,从铈到镥则是逐渐减小。这种镧系元素的原子半径和离子半径随原子序数的增加而逐渐减小的现象称为镧系收缩。
鑭系收縮現象的存在讓鑭系元素之間的原子半徑與離子半徑產生不同,從而影響它們的化學性質。如果沒有鑭系收縮現象,鑭系元素的分離將會變得極為困難。
| 原子序数 | 元素名称 | 原子半径(pm) | +2离子半径(pm) | +3离子半径(pm) | +4离子半径(pm) |
|---|---|---|---|---|---|
| 58 | 铈(Ce) | 182.47 | —— | 103.4 | 92.0 |
| 59 | 镨(Pr) | 182.79 | —— | 101.3 | 90.0 |
| 60 | 钕(Nd) | 182.14 | —— | 99.5 | —— |
| 61 | 钷(Pm) | 181.12 | —— | 97.9 | —— |
| 62 | 钐(Sm) | 180.41 | 111.0 | 96.4 | —— |
| 63 | 铕(Eu) | 204.18 | 109.0 | 95.0 | —— |
| 64 | 钆(Gd) | 180.13 | —— | 93.8 | 84.0 |
| 65 | 铽(Tb) | 178.33 | —— | 92.3 | 84.0 |
| 66 | 镝(Dy) | 177.40 | —— | 90.8 | —— |
| 67 | 钬(Ho) | 176.61 | —— | 89.4 | —— |
| 68 | 铒(Er) | 175.66 | —— | 88.1 | —— |
| 69 | 铥(Tm) | 174.62 | 94.0 | 86.9 | —— |
| 70 | 镱(Yb) | 193.92 | 93.0 | 85.8 | —— |
| 71 | 镥(Lu) | 173.49 | —— | 84.8 | —— |
离子的颜色
| 氧化態 | 鑭 | 鈰 | 鐠 | 釹 | 鉕 | 釤 | 銪 | 釓 | 鋱 | 鏑 | 鈥 | 鉺 | 銩 | 鐿 | 鎦 |
| +2 | Sm2+ | Eu2+ | Tm2+ | Yb2+ | |||||||||||
| +3 | La3+ | Ce3+ | Pr3+ | Nd3+ | Pm3+ | Sm3+ | Eu3+ | Gd3+ | Tb3+ | Dy3+ | Ho3+ | Er3+ | Tm3+ | Yb3+ | Lu3+ |
| +4 | Ce4+ | Pr4+ | Nd4+ | Tb4+ | Dy4+ |
镧系元素的硝酸盐 Ln(NO3)3·6H2O(不含钷):
分布
鑭系元素在地殼中常和鈧、釔兩元素一同出現在獨居石、氟碳鈰礦、磷釔礦和矽鈹釔礦等礦物中,而豐度也比大部份過渡元素要高(具放射性的鉕僅以痕量存在,任何时刻其存量都不到1公斤),不過由於它們彼此之間的化學性質非常相似,因此不易從其礦石中萃取。
用途
- 參見:稀土元素
鑭系元素被广泛应用于國防工業、冶金、机械、電子、石油、化工、玻璃、陶瓷、纺织、皮革、农牧养殖等各传统方面领域,在社会生活中几乎随处可见。
作为改性添加元素在钢铁和有色金属中加入极少量鑭系元素就能明显改善金属材料性能,提高钢材的强度及耐磨性和抗腐蚀性能力。[4]
對生物的影響
尚未發現任何鑭系元素在生物體中有特殊的作用。鉕由於具有放射性,對生物而言是高毒性的物質。
参考文献
参见
| 元素周期表 | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IA 1 |
IIA 2 |
IIIB 3 |
IVB 4 |
VB 5 |
VIB 6 |
VIIB 7 |
VIIIB 8 |
VIIIB 9 |
VIIIB 10 |
IB 11 |
IIB 12 |
IIIA 13 |
IVA 14 |
VA 15 |
VIA 16 |
VIIA 17 |
VIIIA 18 | ||||||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
|