血管紧张素转化酶2
血管紧张素转化酶2(英语:Angiotensin-converting enzyme 2,ACE2;人类的ACE2常被称为hACE2[5])在人类基因组中由X染色体上的基因编码,是一种表现于肺、动脉、心脏、肾脏与肠道等组织细胞表面的膜蛋白,为血管紧张素Ⅰ转化酶(ACE)的一个旁系同源体。
ACE2有切割多肽的功能,其多肽酶结构域位于细胞膜外侧,一般在细胞膜上作用,可被脱落酶切割后脱离细胞、自组织间移除。ACE2可分别将血管紧张素I和血管紧张素II转化为血管收缩素(1-9)和血管收缩素(1-7)[6][7],因而在心血管组织中有抗氧化与抗发炎等功能,在肺脏中可避免肺组织的损伤,在骨骼肌中或许能抑制肌肉纤维化。ACE2的表现可缓解许多心血管疾病的症状,其表现量的下降则与这些疾病有相关性,有研究尝试开发体外合成的人重组ACE2(rhACE2)为这些疾病的一种药物。除切割多肽外,ACE2还有若干和多肽酶无关的功能。
ACE2还被SARS-CoV、SARS-CoV-2(属乙型冠状病毒)和人类冠状病毒NL63(属甲型冠状病毒)等冠状病毒用作感染细胞的受体[8],这些病毒刺突蛋白的受体结合域[9](RBD,receptor binding domain)可结合ACE2,进而使病毒进入细胞内。三种病毒的RBD均与ACE2的相同区域结合,但NL63病毒的RBD结构和另两者差异较大,与ACE2的结合应为趋同演化的结果,且结合力较另外两种病毒弱。SARS相关病毒也并非皆以ACE2为感染细胞的受体,SARS-CoV-2支系的共祖可能具有和ACE2结合的能力,此支系的病毒又与SARS-CoV支系的病毒发生重组,使部分SARS-CoV相关病毒也获得此能力。
结构
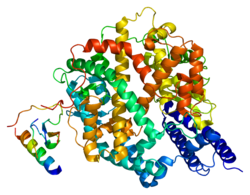
[编辑]血管紧张素转化酶2(ACE2)最早于2000年自cDNA基因库中被发现,为血管紧张素转化酶(ACE)第一个被发现的旁系同源体[6],ACE2的基因位于人类基因组中的X染色体,包括18个外显子,编码的蛋白由805个胺基酸组成,与ACE的胺基酸序列相似度为42%[10],是一个带有锌离子的金属蛋白,属单次跨膜蛋白(第一型膜蛋白),其N端结构域为一M2多肽酶,位于细胞膜外侧,可再细分为I与II两个子结构域(由一个α螺旋相连)[11];C端则与另一种名为collectrin的蛋白同源,包括疏水的跨膜结构域和一个胺基酸转运体结构域,位于细胞内[12]。
ACE2因有跨膜区域而造成其结构测定的困难,过去仅知其N端多肽酶的结构,直到2020年科学家才用低温电子显微镜测出了与另一蛋白B0AT1结合状态的完整ACE2结构,发现两个ACE2和两个B0AT1组成一复合体,复合体中两个ACE2有交互作用,B0AT1间则无交互作用,仅与邻近的ACE2作用,因此研究人员推测细胞膜上的ACE2也可能会形成二聚体[13][14]。
切割机理
[编辑]ACE2的活性位点有一个锌离子(位于多肽酶的子结构域I),和ACE2的两个组胺酸、一个麸胺酸与一个水分子错合,切割多肽时,错合的水分子作为一亲核基,进攻多肽的羰基,形成四面体形的中间产物,并将质子转移到麸胺酸上,此时组胺酸上的氢离子转移到要被切除的胺基酸之胺基上,随后肽键断裂,此胺基酸作为离去基从中间产物脱离,并从麸胺酸处获得氢离子[11]。
表现组织
[编辑]人体几乎所有器官组织都有表现血管紧张素转化酶(ACE),而血管紧张素转化酶2(ACE2)则表现于II型肺泡细胞、小肠肠上皮细胞、血管内皮细胞、血管平滑肌细胞、肾脏上皮细胞等,脑部许多神经元与胶细胞可能也有表现ACE2[10][15]。多数组织中ACE2的转录都是由一个较接近其基因的启动子起始,但肺脏中ACE2基因的转录多起始于一个较远的启动子,两启动子转录出的mRNA5端序列稍有不同[16][17]。
功能
[编辑]切割多肽
[编辑]| 血管紧张素转化酶2 | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| 识别码 | |||||||
| EC编号 | 3.4.17.23 | ||||||
| 数据库 | |||||||
| IntEnz | IntEnz浏览 | ||||||
| BRENDA | BRENDA入口 | ||||||
| ExPASy | NiceZyme浏览 | ||||||
| KEGG | KEGG入口 | ||||||
| MetaCyc | 代谢路径 | ||||||
| PRIAM | 概述 | ||||||
| PDB | RCSB PDB PDBj PDBe PDBsum | ||||||
| |||||||
血管紧张素转化酶2主要的功能是与血管紧张素Ⅰ转化酶(ACE)拮抗,ACE可将无活性的血管收缩素Ⅰ切割成血管收缩素II,后者可促进抗利尿激素与醛固酮的分泌,以及刺激血管平滑肌收缩,使血压上升;ACE2则分解血管收缩素Ⅰ和血管收缩素II以抑制其作用,将其C端的胺基酸移除,分别将前者转化成血管收缩素(1-9),将后者转化成血管收缩素(1-7)[注 1],其中切割血管收缩素II比切割血管收缩素I的能力高出许多,切割的产物中,血管收缩素(1-9)的功能不明,血管收缩素(1-7)则可刺激一氧化氮合成、抑制MAPK/ERK途径与TGFβ途径、以及抑制活性氧物质的生成,因此在心血管组织中有抗氧化与抗发炎等功能[10][13]。许多研究结果显示ACE2表现量的下降与数种心血管疾病有相关性[19]。
肺泡细胞表现的ACE2有保护肺组织的功能。血管收缩素II可促进肺泡细胞凋亡与肺纤维化[20],因此ACE2将其分解可保护肺免于损伤[21],加上血管收缩素(1-7)可与MAS1受体结合,启动下游反应以抑制血管收缩素II的作用[21][22]。
在骨骼肌中,血管收缩素II与血管收缩素(1-7)均有重要功能。血管收缩素II透过多种途径降低肌肉蛋白质的合成,包括抑制Akt-mTOR途径、促进肌萎缩素1与肌环指蛋白1的合成、生成活性氧物质而活化胱天蛋白酶途径使细胞凋亡等,肌肉蛋白合成与分解的失衡会造成肌萎缩、肌纤维化等症状[23][24],因此将血管收缩素II被转化成血管收缩素(1-7)可停止其作用,且后者还可与MAS1受体结合,活化另一条反应途径而抑制肌纤维化[13][25]。相较之下ACE2在骨骼肌的直接影响还有待更多研究阐明,有初步研究结果显示在萎缩的肌肉组织中,ACE2可能可降低纤维化[13][26]。
由于ACE2的表现可缓解许多心血管疾病的症状,有研究尝试在体外以细胞株合成ACE2(人重组ACE2;rhACE2)以期作为这些疾病的一种疗法[17][27]。
除了切割血管收缩素II外,ACE2还可切割强啡肽A、apelin-13[28]、apelin-36、去精胺酸缓激肽(des-Arg(9) bradykinin)、β-酪啡肽等其他多肽,惟其生理意义仍不明[17][29]。
其他
[编辑]除了切割多肽外,ACE2还有些与其蛋白酶活性无关的功能。有研究显示ACE2可与整合素结合,有助于细胞黏附[13][30]。此外ACE2还参与了另一蛋白B0AT1的膜囊泡运输过程,为其伴护蛋白,与B0AT1形成一复合体,协助将其转运至细胞膜上[14]。
移除
[编辑]ACE2的跨膜结构域可被一种称为金属蛋白酶17(MMP17)的脱落酶切割,将其胞外部分释放到血液中,进而从组织间移除[31][32],此过程受到许多调控,例如有一种钙调蛋白可与ACE2结合以抑制MMP17的切割[33],血管收缩素II也可促进MMP17的活性,把会将其分解的ACE2移除[34],另外许多病理状况、发炎反应也可促进MMP17对ACE2的切割。脱落酶的切割会造成心血管组织中ACE2的流失、血液中ACE2的浓度升高,因此后者可当作心脏衰竭、心房颤动、动脉粥样硬化、慢性肾脏病、心肌梗塞与中风等多种疾病的生物标记[13][35]。
冠状病毒受体
[编辑]
血管紧张素转化酶2被许多冠状病毒用来当作感染细胞的受体,包括造成普通感冒的人类冠状病毒NL63(属甲型冠状病毒)[36]、与MERS-CoV关系接近的祖鲁棕蝠冠状病毒(NeoCoV)[37]、造成SARS的SARS-CoV[38][39]和造成2019冠状病毒病的SARS-CoV-2(属乙型冠状病毒)[40]等,这些病毒刺突蛋白S1结构域中的受体结合结构域(receptor binding domain;RBD)和ACE2胞外的区域结合后,刺突蛋白可能被细胞表面的跨膜丝氨酸蛋白酶2(TMPRSS2)切割,促使病毒外膜和宿主细胞膜融合而让病毒进入细胞质[41];此外SARS-CoV与SARS-CoV-2[42]还可能在不被TMPRSS2切割的情况下,与ACE2受体一起借由内吞作用进入细胞,随后其刺突蛋白在溶体中被组织蛋白酶切割后,再从溶体进入细胞质中[43][44][45]。
SARS-CoV与SARS-CoV-2的RBD结构相似,胺基酸序列相似度为72%,SARS-CoV的RBD和ACE2结合时,与其直接接触的胺基酸共有16个,其中8个位点在SARS-CoV-2中为对应相同胺基酸,另外8个则不同,因此两者与ACE2结合的机制略有差异[46]。SARS-CoV-2的RBD有6个胺基酸为与ACE2结合所需,包括白胺酸455、苯丙胺酸486、麸酰胺酸493、丝胺酸494、天门冬酰胺501与酪氨酸505[47],与ACE2的结合力高于SARS-CoV[48]。人类冠状病毒NL63之RBD则与前两者的结构差异较大,却能和ACE2的同一区域结合,为趋同演化的结果,但NL63和ACE2的结合力较弱,可能是其感染症状较轻微的原因之一[46]。
而SARS相关病毒亦非皆以ACE2为感染细胞的受体,SARSr-CoV中,使用ACE2为受体的病毒株包含SARS-CoV支系的果子狸SARS冠状病毒、WIV1、SHC014、WIV16、LYRa11、Rs4874、Rs7327等(以上病毒的RBD序列可再分成两支),以及SARS-CoV-2支系的RaTG13和穿山甲冠状病毒,上述以ACE2为受体的蝙蝠病毒皆是在中国云南省发现;SARS-CoV支系的YNLF_31C、YNLF_34C、BtKY72、BM48-31、16BO133、HKU3、Rm1和Rf1等,以及SARS-CoV-2支系的RmYN02之RBD则应无法与ACE2结合,而是使用其他蛋白作为感染的受体,这些病毒株的RBD大多具有两段序列缺失,可能因此影响和ACE2结合的能力[注 2][49]。SARSr-CoV中,与ACE2的结合能力应为多次起源,有学者提出SARS-CoV-2支系病毒的共祖可能可和ACE2结合(RmYN02则是后来才丧失了此能力),后来某个SARS-CoV-2支系的病毒曾和SARS-CoV支系的病毒发生重组,造成部分SARS-CoV支系的病毒也获得了和ACE2结合的能力[49]。
演化
[编辑]早期的脊索动物已具有ACE2,海鞘(尾索动物)与文昌鱼(头索动物)皆尚无血管紧张素等肾素-血管紧张素系统的多数蛋白,但已具有ACE与ACE2[50]。脊椎动物(鱼类、两生类、爬行类、鸟类与哺乳类)皆具有ACE2,且其结构的保守度很高[46]。此外有些细菌(如野油菜黄单胞菌柑橘致病变种)具有和ACE同源的蛋白,体外实验结果显示其具有将血管紧张素I切割成血管紧张素II的能力[51],以各生物中的ACE与ACE2序列制作的系统发生树显示细菌ACE与海鞘、文昌鱼的ACE2关系较为接近,可能是由海鞘的ACE2经水平基因转移至细菌基因组中[50]。
有研究分析哺乳类的ACE2序列,发现有4%的位点(皆位于具有酵素活性的结构域)正发生定向选择[52]。
参见
[编辑]注脚
[编辑]参考文献
[编辑]- ^ 1.0 1.1 1.2 GRCh38: Ensembl release 89: ENSG00000130234 - Ensembl, May 2017
- ^ 2.0 2.1 2.2 GRCm38: Ensembl release 89: ENSMUSG00000015405 - Ensembl, May 2017
- ^ Human PubMed Reference:. National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Mouse PubMed Reference:. National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Kasmi Y, Khataby K, Souiri A. Coronaviridae: 100,000 Years of Emergence and Reemergence. Ennaji MM (编). Emerging and Reemerging Viral Pathogens. Volume 1: Fundamental and Basic Virology Aspects of Human, Animal and Plant Pathogens. Elsevier. 2019: 135 [2021-03-04]. ISBN 978-0-12-819400-3. (原始内容存档于2020-07-24).
- ^ 6.0 6.1 Donoghue M, Hsieh F, Baronas E, Godbout K, Gosselin M, Stagliano N; et al. A novel angiotensin-converting enzyme-related carboxypeptidase (ACE2) converts angiotensin I to angiotensin 1-9.. Circ Res. 2000, 87 (5): E1–9. PMID 10969042. doi:10.1161/01.res.87.5.e1.
- ^ Keidar S, Kaplan M, Gamliel-Lazarovich A. ACE2 of the heart: From angiotensin I to angiotensin (1-7). Cardiovasc Res. 2007, 73 (3): 463–9 [2008-12-11]. PMID 17049503. (原始内容存档于2009-01-23).
- ^ Weiss SR, Navas-Martin S. Angiotensin-converting enzyme 2--a new cardiac regulator. Microbiol Mol Biol Rev. 2005, 69 (4): 635–64. PMID 16339739.
- ^ 沈媚, 陈冰清, 于瑞嵩, 朱于敏, 李震. 冠状病毒S蛋白及其受体的结构和功能. 微生物学通报. 2017, 44 (10): 2452-2462 [2021-09-12]. (原始内容存档于2022-05-02).
- ^ 10.0 10.1 10.2 Burrell LM, Johnston CI, Tikellis C, Cooper ME. ACE2, a new regulator of the renin-angiotensin system.. Trends Endocrinol Metab. 2004, 15 (4): 166–9 [2021-03-04]. PMC 7128798
 . PMID 15109615. doi:10.1016/j.tem.2004.03.001. (原始内容存档于2021-03-04).
. PMID 15109615. doi:10.1016/j.tem.2004.03.001. (原始内容存档于2021-03-04).
- ^ 11.0 11.1 Towler P, Staker B, Prasad SG, Menon S, Tang J, Parsons T; et al. ACE2 X-ray structures reveal a large hinge-bending motion important for inhibitor binding and catalysis.. J Biol Chem. 2004, 279 (17): 17996–8007. PMID 14754895. doi:10.1074/jbc.M311191200.
- ^ Turner AJ. Chapter 25: ACE2 Cell Biology, Regulation, and Physiological Functions. Unger T, Ulrike M, Steckelings UM, dos Santos RA (编). The Protective Arm of the Renin Angiotensin System (RAS): Functional Aspects and Therapeutic Implications. Academic Press. 2015: 185–189. ISBN 978-0-12-801364-9. doi:10.1016/B978-0-12-801364-9.00025-0.
- ^ 13.0 13.1 13.2 13.3 13.4 13.5 13.6 Yamamoto K, Takeshita H, Rakugi H. ACE2, angiotensin 1-7 and skeletal muscle: review in the era of COVID-19.. Clin Sci (Lond). 2020, 134 (22): 3047–3062 [2021-03-04]. PMC 7687025
 . PMID 33231620. doi:10.1042/CS20200486. (原始内容存档于2021-03-04).
. PMID 33231620. doi:10.1042/CS20200486. (原始内容存档于2021-03-04).
- ^ 14.0 14.1 Yan R, Zhang Y, Li Y, Xia L, Guo Y, Zhou Q. Structural basis for the recognition of SARS-CoV-2 by full-length human ACE2.. Science. 2020, 367 (6485): 1444–1448 [2021-03-04]. PMC 7164635
 . PMID 32132184. doi:10.1126/science.abb2762. (原始内容存档于2021-03-04).
. PMID 32132184. doi:10.1126/science.abb2762. (原始内容存档于2021-03-04).
- ^ Kabbani, Nadine; Olds, James L. Does COVID19 infect the brain? If so, smokers might be at a higher risk. Molecular Pharmacology. 1 April 2020, 97 (5): 351–353. PMC 7237865
 . PMID 32238438. doi:10.1124/molpharm.120.000014.
. PMID 32238438. doi:10.1124/molpharm.120.000014.
- ^ Pedersen KB, Chhabra KH, Nguyen VK, Xia H, Lazartigues E. The transcription factor HNF1α induces expression of angiotensin-converting enzyme 2 (ACE2) in pancreatic islets from evolutionarily conserved promoter motifs.. Biochim Biophys Acta. 2013, 1829 (11): 1225–35 [2021-03-04]. PMC 3838857
 . PMID 24100303. doi:10.1016/j.bbagrm.2013.09.007. (原始内容存档于2021-03-04).
. PMID 24100303. doi:10.1016/j.bbagrm.2013.09.007. (原始内容存档于2021-03-04).
- ^ 17.0 17.1 17.2 Jia H, Yue X, Lazartigues E. ACE2 mouse models: a toolbox for cardiovascular and pulmonary research.. Nat Commun. 2020, 11 (1): 5165 [2021-03-04]. PMC 7560817
 . PMID 33057007. doi:10.1038/s41467-020-18880-0. (原始内容存档于2021-03-04).
. PMID 33057007. doi:10.1038/s41467-020-18880-0. (原始内容存档于2021-03-04).
- ^ Domenig O, Manzel A, Grobe N, Königshausen E, Kaltenecker CC, Kovarik JJ; et al. Neprilysin is a Mediator of Alternative Renin-Angiotensin-System Activation in the Murine and Human Kidney.. Sci Rep. 2016, 6: 33678. PMC 5030486
 . PMID 27649628. doi:10.1038/srep33678.
. PMID 27649628. doi:10.1038/srep33678.
- ^ Raizada MK, Ferreira AJ. ACE2: a new target for cardiovascular disease therapeutics.. J Cardiovasc Pharmacol. 2007, 50 (2): 112–9 [2021-03-04]. PMID 17703127. doi:10.1097/FJC.0b013e3180986219. (原始内容存档于2021-03-04).
- ^ Uhal BD, Li X, Xue A, Gao X, Abdul-Hafez A. Regulation of alveolar epithelial cell survival by the ACE-2/angiotensin 1-7/Mas axis.. Am J Physiol Lung Cell Mol Physiol. 2011, 301 (3): L269–74 [2021-03-04]. PMC 3174737
 . PMID 21665960. doi:10.1152/ajplung.00222.2010. (原始内容存档于2021-03-04).
. PMID 21665960. doi:10.1152/ajplung.00222.2010. (原始内容存档于2021-03-04).
- ^ 21.0 21.1 Samavati L, Uhal BD. ACE2, Much More Than Just a Receptor for SARS-COV-2.. Front Cell Infect Microbiol. 2020, 10: 317. PMC 7294848
 . PMID 32582574. doi:10.3389/fcimb.2020.00317.
. PMID 32582574. doi:10.3389/fcimb.2020.00317.
- ^ Gopallawa I, Uhal BD. Angiotensin-(1-7)/mas inhibits apoptosis in alveolar epithelial cells through upregulation of MAP kinase phosphatase-2.. Am J Physiol Lung Cell Mol Physiol. 2016, 310 (3): L240–8. PMC 4888557
 . PMID 26637635. doi:10.1152/ajplung.00187.2015.
. PMID 26637635. doi:10.1152/ajplung.00187.2015.
- ^ Cabello-Verrugio C, Morales MG, Rivera JC, Cabrera D, Simon F. Renin-angiotensin system: an old player with novel functions in skeletal muscle.. Med Res Rev. 2015, 35 (3): 437–63. PMID 25764065. doi:10.1002/med.21343.
- ^ Winslow MA, Hall SE. Muscle wasting: A review of exercise, classical and non-classical RAS axes.. J Cell Mol Med. 2019, 23 (9): 5836–5845. PMC 6714228
 . PMID 31273946. doi:10.1111/jcmm.14412.
. PMID 31273946. doi:10.1111/jcmm.14412.
- ^ Morales MG, Abrigo J, Meneses C, Cisternas F, Simon F, Cabello-Verrugio C. Expression of the Mas receptor is upregulated in skeletal muscle wasting.. Histochem Cell Biol. 2015, 143 (2): 131–41 [2021-03-04]. PMID 25208653. doi:10.1007/s00418-014-1275-1. (原始内容存档于2021-03-04).
- ^ Riquelme C, Acuña MJ, Torrejón J, Rebolledo D, Cabrera D, Santos RA; et al. ACE2 is augmented in dystrophic skeletal muscle and plays a role in decreasing associated fibrosis.. PLoS One. 2014, 9 (4): e93449 [2021-03-04]. PMC 3973684
 . PMID 24695436. doi:10.1371/journal.pone.0093449. (原始内容存档于2021-03-04).
. PMID 24695436. doi:10.1371/journal.pone.0093449. (原始内容存档于2021-03-04).
- ^ Mirabito Colafella, Katrina M.; Uijl, Estrellita; Jan Danser, A.H. Interference With the Renin–Angiotensin System (RAS): Classical Inhibitors and Novel Approaches: 523–530. 2019. doi:10.1016/B978-0-12-801238-3.65341-2.
- ^ Yang P, Kuc RE, Brame AL, Dyson A, Singer M, Glen RC; et al. [Pyr1]Apelin-13(1-12) Is a Biologically Active ACE2 Metabolite of the Endogenous Cardiovascular Peptide [Pyr1]Apelin-13.. Front Neurosci. 2017, 11: 92 [2021-03-04]. PMC 5329011
 . PMID 28293165. doi:10.3389/fnins.2017.00092. (原始内容存档于2021-03-04).
. PMID 28293165. doi:10.3389/fnins.2017.00092. (原始内容存档于2021-03-04).
- ^ Nicholls J, Peiris M. Good ACE, bad ACE do battle in lung injury, SARS.. Nat Med. 2005, 11 (8): 821–2. PMC 7095949
 . PMID 16079870. doi:10.1038/nm0805-821.
. PMID 16079870. doi:10.1038/nm0805-821.
- ^ Schmoldt A, Benthe HF, Haberland G. Digitoxin metabolism by rat liver microsomes.. Biochem Pharmacol. 1975, 24 (17): 1639–41 [2021-03-04]. doi:10.1371/journal.pone.0034747. (原始内容存档于2021-03-04).
- ^ Lambert DW, Yarski M, Warner FJ, Thornhill P, Parkin ET, Smith AI, et al. Tumor necrosis factor-alpha convertase (ADAM17) mediates regulated ectodomain shedding of the severe-acute respiratory syndrome-coronavirus (SARS-CoV) receptor, angiotensin-converting enzyme-2 (ACE2). The Journal of Biological Chemistry. August 2005, 280 (34): 30113–9. PMID 15983030. doi:10.1074/jbc.M505111200.
- ^ Patel VB, Clarke N, Wang Z, Fan D, Parajuli N, Basu R, et al. Angiotensin II induced proteolytic cleavage of myocardial ACE2 is mediated by TACE/ADAM-17: a positive feedback mechanism in the RAS. Journal of Molecular and Cellular Cardiology. January 2014, 66: 167–76. PMID 24332999. doi:10.1016/j.yjmcc.2013.11.017.
- ^ Lambert DW, Clarke NE, Hooper NM, Turner AJ. Calmodulin interacts with angiotensin-converting enzyme-2 (ACE2) and inhibits shedding of its ectodomain.. FEBS Lett. 2008, 582 (2): 385–90. PMC 7094239
 . PMID 18070603. doi:10.1016/j.febslet.2007.11.085.
. PMID 18070603. doi:10.1016/j.febslet.2007.11.085.
- ^ Xu P, Derynck R. Direct activation of TACE-mediated ectodomain shedding by p38 MAP kinase regulates EGF receptor-dependent cell proliferation.. Mol Cell. 2010, 37 (4): 551–66. PMC 4240279
 . PMID 20188673. doi:10.1016/j.molcel.2010.01.034.
. PMID 20188673. doi:10.1016/j.molcel.2010.01.034.
- ^ Patel VB, Zhong JC, Grant MB, Oudit GY. Role of the ACE2/Angiotensin 1-7 Axis of the Renin-Angiotensin System in Heart Failure.. Circ Res. 2016, 118 (8): 1313–26 [2021-03-04]. PMC 4939482
 . PMID 27081112. doi:10.1161/CIRCRESAHA.116.307708. (原始内容存档于2021-03-04).
. PMID 27081112. doi:10.1161/CIRCRESAHA.116.307708. (原始内容存档于2021-03-04).
- ^ Gene: ACE2, angiotensin I converting enzyme 2. National Center for Biotechnology Information (NCBI). U.S. National Library of Medicine. 2020-02-28 [2021-02-22]. (原始内容存档于2014-12-24).
- ^ Xiong, Q., Cao, L., Ma, C.; et al. Close relatives of MERS-CoV in bats use ACE2 as their functional receptors. Nature. 2022, 612: 748–757. doi:10.1038/s41586-022-05513-3.
- ^ Fehr AR, Perlman S. Coronaviruses: an overview of their replication and pathogenesis. Coronaviruses. Methods in Molecular Biology 1282. Springer New York. 2015: 1–23. ISBN 978-1-4939-2437-0. PMC 4369385
 . PMID 25720466. doi:10.1007/978-1-4939-2438-7_1.
. PMID 25720466. doi:10.1007/978-1-4939-2438-7_1. Many α-coronaviruses utilize aminopeptidase N (APN) as their receptor, SARS-CoV and HCoV-NL63 use angiotensin-converting enzyme 2 (ACE2) as their receptor, MHV enters through CEACAM1, and the recently identified MERS-CoV binds to dipeptidyl-peptidase 4 (DPP4) to gain entry into human cells (See Table 1 for a list of known CoV receptors).
- ^ Li F. Receptor recognition and cross-species infections of SARS coronavirus. Antiviral Research. October 2013, 100 (1): 246–54. PMC 3840050
 . PMID 23994189. doi:10.1016/j.antiviral.2013.08.014.
. PMID 23994189. doi:10.1016/j.antiviral.2013.08.014.
- ^ What are the official names of the disease and the virus that causes it?. Q&A on coronaviruses. World Health Organization. [22 February 2020]. (原始内容存档于2020-03-05).
- ^ Akhmerov Akbarshakh; Marban Eduardo. COVID-19 and the Heart. Circulation Research. 2020, 0 (10): 1443–1455. PMC 7188058
 . PMID 32252591. doi:10.1161/CIRCRESAHA.120.317055.
. PMID 32252591. doi:10.1161/CIRCRESAHA.120.317055.
- ^ Ou X, Liu Y, Lei X, Li P, Mi D, Ren L; et al. Characterization of spike glycoprotein of SARS-CoV-2 on virus entry and its immune cross-reactivity with SARS-CoV.. Nat Commun. 2020, 11 (1): 1620 [2021-03-04]. PMC 7100515
 . PMID 32221306. doi:10.1038/s41467-020-15562-9. (原始内容存档于2021-03-04).
. PMID 32221306. doi:10.1038/s41467-020-15562-9. (原始内容存档于2021-03-04).
- ^ Wang H, Yang P, Liu K, Guo F, Zhang Y, Zhang G, Jiang C. SARS coronavirus entry into host cells through a novel clathrin- and caveolae-independent endocytic pathway. Cell Research. February 2008, 18 (2): 290–301. PMC 7091891
 . PMID 18227861. doi:10.1038/cr.2008.15.
. PMID 18227861. doi:10.1038/cr.2008.15.
- ^ Millet JK, Whittaker GR. Physiological and molecular triggers for SARS-CoV membrane fusion and entry into host cells. Virology. April 2018, 517: 3–8. PMC 7112017
 . PMID 29275820. doi:10.1016/j.virol.2017.12.015.
. PMID 29275820. doi:10.1016/j.virol.2017.12.015.
- ^ Huang IC, Bosch BJ, Li F, Li W, Lee KH, Ghiran S; et al. SARS coronavirus, but not human coronavirus NL63, utilizes cathepsin L to infect ACE2-expressing cells.. J Biol Chem. 2006, 281 (6): 3198–203 [2021-03-04]. PMID 16339146. doi:10.1074/jbc.M508381200. (原始内容存档于2021-03-04).
- ^ 46.0 46.1 46.2 Chen Y, Guo Y, Pan Y, Zhao ZJ. Structure analysis of the receptor binding of 2019-nCoV.. Biochem Biophys Res Commun. 2020. PMC 7092824
 . PMID 32081428. doi:10.1016/j.bbrc.2020.02.071.
. PMID 32081428. doi:10.1016/j.bbrc.2020.02.071.
- ^ Andersen KG, Rambaut A, Lipkin WI, Holmes EC, Garry RF. The proximal origin of SARS-CoV-2.. Nat Med. 2020, 26 (4): 450–452 [2021-03-04]. PMC 7095063
 . PMID 32284615. doi:10.1038/s41591-020-0820-9. (原始内容存档于2021-03-04).
. PMID 32284615. doi:10.1038/s41591-020-0820-9. (原始内容存档于2021-03-04).
- ^ Shang J, Wan Y, Luo C, Ye G, Geng Q, Auerbach A; et al. Cell entry mechanisms of SARS-CoV-2.. Proc Natl Acad Sci U S A. 2020, 117 (21): 11727–11734. PMC 7260975
 . PMID 32376634. doi:10.1073/pnas.2003138117.
. PMID 32376634. doi:10.1073/pnas.2003138117.
- ^ 49.0 49.1 49.2 Wells, H L; Letko, M; Lasso, G; Ssebide, B; Nziza, J; Byarugaba, D K; Navarrete-Macias, I; Liang, E; et al. The evolutionary history of ACE2 usage within the coronavirus subgenus Sarbecovirus. Virus Evolution. 2021. ISSN 2057-1577. doi:10.1093/ve/veab007.
- ^ 50.0 50.1 Fournier D, Luft FC, Bader M, Ganten D, Andrade-Navarro MA. Emergence and evolution of the renin-angiotensin-aldosterone system.. J Mol Med (Berl). 2012, 90 (5): 495–508. PMC 3354321
 . PMID 22527880. doi:10.1007/s00109-012-0894-z.
. PMID 22527880. doi:10.1007/s00109-012-0894-z.
- ^ Rivière G, Michaud A, Corradi HR, Sturrock ED, Ravi Acharya K, Cogez V; et al. Characterization of the first angiotensin-converting like enzyme in bacteria: Ancestor ACE is already active.. Gene. 2007, 399 (1): 81–90. PMC 7127174
 . PMID 17597310. doi:10.1016/j.gene.2007.05.010.
. PMID 17597310. doi:10.1016/j.gene.2007.05.010.
- ^ Bibiana S O F, Vargas-Pinilla P, Amorim CEG, Sortica VA, Bortolini MC. ACE2 diversity in placental mammals reveals the evolutionary strategy of SARS-CoV-2.. Genet Mol Biol. 2020, 43 (2): e20200104. PMC 7278419
 . PMID 32520981. doi:10.1590/1678-4685-GMB-2020-0104.
. PMID 32520981. doi:10.1590/1678-4685-GMB-2020-0104.
外部链接
[编辑]- Human ACE2 genome location and ACE2 gene details page in the UCSC Genome Browser.