硫化物
| 硫化物 | |
|---|---|
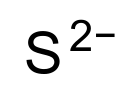
| |
| 系統名 Sulfide(2−)[1] (additive), recommended name Sulfanediide (substitutive),[1] not common, rarely used, sometimes generated by automated nomenclature software in organic chemistry | |
| 識別 | |
| CAS號 | 18496-25-8 |
| PubChem | 29109 |
| ChemSpider | 27079 |
| SMILES |
|
| ChEBI | 15138 |
| 性質 | |
| 化學式 | S |
| 摩爾質量 | 32.07 g·mol−1 |
| 相關物質 | |
| 其他陰離子 | 氧化物 硒化物 碲化物 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
無機化學中,硫化物指電正性較強的金屬或非金屬與硫形成的一類化合物。大多數金屬硫化物都可看作氫硫酸的鹽。由於氫硫酸是二元弱酸,因此硫化物可分為酸式鹽(HS−,氫硫化物)、正鹽(S2−)和多硫化物(Sn2−)三類。
有機化學中,硫化物(英文:Sulfide)指含有二價硫的有機化合物。根據具體情況的不同,有機硫化物可包括:硫醚(R-S-R)、硫酚/硫醇(Ar/R-SH)、硫醛(R-CSH)、硫代羧酸(S取代羧基中的一個或兩個O,如R-CO-SH、R-CS-OH、R-CS-SH)和二硫化物(R-S-S-R)等。參見有機硫化合物。
合成
[編輯]無機硫化物通常可通過以下方法合成:
- 單質直接化合,例如:
- C + 2S -1123~1223K→ CS2
- Na2SO4 + 4C -1373K→ Na2S + 4CO
- In2S3 + 2H2 → In2S + 2H2S
- 溶液中或高溫的複分解反應,例如:
- FeCl2 + H2S → FeS↓ + 2HCl
- 3SiO2 + 2Al2S3 -1373K→ 3SiS2 + 2Al2O3
- 以硫代酸鹽為原料製取,例如:
- (NH4)2MoO4 + 4(NH4)2S + 4H2O → (NH4)2[MoS4] + 8NH3.H2O
- (NH4)2[MoS4] + 2HCl —Δ→ MoS3 + H2S + 2NH4Cl
- 高價硫化物加熱分解,例如:
- MoS3 -△→ MoS2 + S
物理性質
[編輯]| Al2S3 | 黃 | GeS | 灰黑 | P4S5 | 亮黃 | CdS | 黃 |
| Ga2S3 | 黃 | SnS2 | 黃 | P4S10 | 黃 | HgS | 紅/黑 |
| In2S3 | 黃/紅 | SnS | 棕黑 | As4S4 | 紅 | MnS | 綠/肉 |
| InS | 酒紅 | PbS | 黑 | As4S6 | 黃 | MoS3 | 紅棕 |
| Tl2S3 | 藍黑 | As4S10 | 淡黃 | RuS2 | 灰藍 | ||
| Tl2S | 黑 | Sb2S3 | 橙紅 | FeS2 | 黃 | ||
| Bi2S3 | 棕黑 | ||||||
硫化物大多含有鮮艷的顏色,見右表。[2] 除此之外,MoS2、Re2S7、FeS、CoS2、NiS、PtS2、Cu2S、CuS和Ag2S等過渡金屬硫化物都是黑色的。
金屬的酸式硫化物都可溶於水,但正鹽中只有鹼金屬硫化物和硫化銨可溶。一般地講,金屬硫化物的溶解度可通過陽離子極化力(離子電荷數/離子半徑,Z2/r)的大小來預測。陽離子極化能力的增強,將導致化合物共價性的增加,極性減小,因而溶解度也降低。
化學性質
[編輯]水解
[編輯]金屬硫化物在水中都會發生不同程度的水解:
- S2− + H2O → HS− + OH−
- HS− + H2O ⇌ H2S + OH−
H2S的pKa分別約為:pKa1 = 6.89 和 pKa2 = 19±2,[3] 因此金屬硫化物溶液會呈不同程度的鹼性,而鹼金屬的硫化物溶液的鹼性更是可以與相應的氫氧化物匹敵。
S2−不能在水中存在,也無法在超高濃度的CsOH溶液中存在。[4]
灼燒
[編輯]灼燒硫化物礦物時可能發生兩種反應:[5]
- 2PbS + 3O2 → 2PbO + 2SO2
- 硫化物被氧化為相應的可溶硫酸鹽。
以上兩步都是冶煉金屬時,轉化硫化物礦石的重要方法。
氧化
[編輯]硫化物中-2價的硫具有還原性,視條件不同可被氧化為硫、亞硫酸鹽和硫酸鹽等。
- S + 2e− = S2−; -0.407V[6]
酸鹼性
[編輯]硫化物和相應的氧化物類似,其酸鹼性隨周期和族的變化也和氧化物的類似,但硫化物的鹼性不如氧化物強。
| H2S | NaHS | Na2S | As2S3 | As2S5 | Na2S2 |
| H2O | NaOH | Na2O | As2O3 | As2O5 | Na2O2 |
| 鹼性 | 鹼性 | 兩性 | 酸性 | 鹼性 |
同周期元素最高氧化態硫化物從左到右酸性增強;同族元素相同氧化態的硫化物從上到下酸性減弱;同種元素的硫化物中,高氧化態的硫化物酸性更強。因此As2S5酸性強於Sb2S5,而Sb2S5的酸性則要強於SnS2和Sb2S3。
多硫化物
[編輯]多硫化物是含有多硫離子Sn2−的化合物,n=2,3,4,5,6,...,9。多硫化物可由硫在硫化物溶液中煮沸製得,其溶液一般都為黃色,且顏色隨n值的增加而加深。
多硫離子類似於過氧化物,具有氧化性,但不及過氧離子氧化性強:
- S22− + 2e− = 2S2−; E
o= -0.476V - HO2− + H2O + 2e− = 3OH−; E
o= 0.87V
- Sn2− + 2H+ → H2S + (n-1)S
多硫離子還可作配體。例如Na2Sn作用於(η5-C5H5)2TiCl2時,會生成含有TiS5環的配位化合物。
分析
[編輯]- 點滴法[2]
- 點滴法是鑑定S2−和HS−離子的靈敏方法,其步驟為:在點滴板上混合可溶硫化物的鹼性溶液和1%的硝普酸鈉Na2[Fe(CN)5NO](亞硝基鐵氰化鈉)溶液,若試樣中存在S2−離子則會出現不同深度的紅紫色,靈敏度1:50000。其機理可能是[Fe(CN)5(NO)S]4−離子的生成。
- 除此之外,向點滴板中加入試液、濃鹽酸、幾顆對氨基二甲基苯胺晶體和0.1mol/L氯化鐵溶液,若在2~3分鐘後出現藍色,也可證明硫離子的存在。機理是生成了藍色的亞甲基藍。
應用
[編輯]在分析化學中的應用
[編輯]硫化氫系統是傳統且較廣泛的分析陽離子的方法,主要依據各離子硫化物溶解度的顯著差異,將常見的陽離子分成五組。
| 組試劑 | HCl | 0.3 mol/L HCl, H2S 或 0.2~0.6 mol/L HCl TAA,加熱 |
NH3 + NH4Cl (NH4)2S 或 TAA,加熱 |
/ | |
| 組的名稱 | I組 銀組 鹽酸組 |
II組 銅 錫組 硫化氫組 |
III組 鐵組 硫化銨組 |
IV組 鈣鈉組 可溶組 | |
| 組內離子 | Ag+ Hg22+ Pb2+ |
II A Pb2+ Bi3+ Cu2+ Cd2+ |
II B Hg2+ As(III,V) Sb(III,V) Sn(II,IV) |
Al3+ Mn2+ Cr3+ Zn2+ Fe3+ Co2+ Fe2+ Ni2+ |
Ba2+ K+ Ca2+ Na+ Mg2+ NH4+ |
由於H2S氣體毒性大,且儲存不便,故一般多以硫代乙酰胺(CH3CSNH2,TAA)水溶液作沉澱劑。
- 在酸性溶液中TAA水解產生H2S,可替代H2S:
- CH3CSNH2 + H+ + 2H2O ⇌ CH3COOH + NH4+ + H2S↑
- 在氨性溶液中水解生成HS−,可替代(NH4)2S:
- CH3CSNH2 + 2NH3 ⇌ CH3-C(-NH2)=NH + NH4+ + HS−
- 在鹼性溶液中水解生成S2−,可替代Na2S:
- CH3CSNH2 + 3OH− ⇌ CH3COO− + NH3 + H2O + S2−
硫化物的其他應用還有:
- 二硫化鉬是有機合成中的催化劑。由於含硫有機化合物(如噻吩)會使普通氫化催化劑中毒,因此二硫化鉬可用於催化含硫有機物質的加氫反應。
- 硫化鎘可用於製作光電池。
- 硫化鉛被用於製作紅外感應器。
- 多硫化鈣、多硫化鋇和多硫化銨是殺菌劑和殺蟲劑。
- 二硫化碳在工業上被用作溶劑。此外,二硫化碳也被用來製取四氯化碳,有機化學中則用二硫化碳來插入-C(=S)-S-基團。
- 硫化鋅和硫化鎘被用來製造熒光粉,高純度的硫化鎘是良好的半導體。
- 三硫化四磷用於制火柴和煙火。
- 十硫化四磷用於制殺蟲劑、潤滑油添加劑和浮選劑。
- 硫化鈉被大量用於硫化染料的製造、有機藥物和紙漿的生產等。
- 硫化鈣和硫化鋇被用來製造發光漆。
另外,有色金屬硫化物的互熔體也被稱為鋶,是銅、鎳等冶煉過程中的中間產品。鋶中含有貴重金屬。
參見
[編輯]參考資料
[編輯]- ^ 1.0 1.1 sulfide(2−) (CHEBI:15138). Chemical Entities of Biological Interest (ChEBI). UK: European Bioinformatics Institute. [2020-09-22]. (原始內容存檔於2021-04-18).
- ^ 2.0 2.1 張青蓮等。《無機化學叢書》第五卷。北京:科學出版社。
- ^ Giggenbach, W. (1971). Inorg. Chem. 10:1333. Meyer, B.; Ward, K.; Koshlap, K.; & Peter, L. (1983). Inorganic Chemistry 22:2345. Myers, R. J. (1986). Journal of Chemical Education 63:687.
- ^ May, P. M.; Batka, D.; Hefter, G.; Königsberger, E.; Rowland, D. Goodbye to S2− in aqueous solution. Chemical Communications. 2018-02-20, 54 (16): 1980–1983 [2021-01-07]. ISSN 1364-548X. doi:10.1039/C8CC00187A. (原始內容存檔於2021-04-18) (英語).
- ^ Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements, 2nd Edition, Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
- ^ J.A.迪安。《蘭氏化學手冊》第二版。北京:科學出版社,2003年。ISBN 7-03-010409-9
- ^ 宋天佑,徐家寧,程功臻編。《無機化學》下冊。北京:高等教育出版社,2006年。ISBN 7-04-015582-6
- ^ 華中師範大學等編。《分析化學》上冊。北京:高等教育出版社,2005年。ISBN 7-04-009140-2
