臭氧
此條目需要補充更多來源。 (2014年7月23日) |
| 臭氧 | |||
|---|---|---|---|
| |||
| |||

| |||
| IUPAC名 Trioxygen | |||
| 英文名 | Ozone | ||
| 識別 | |||
| CAS號 | 10028-15-6 | ||
| PubChem | 24823 | ||
| ChemSpider | 23208 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | CBENFWSGALASAD-UHFFFAOYAY | ||
| Gmelin | 1101 | ||
| EINECS | 233-069-2 | ||
| ChEBI | 25812 | ||
| RTECS | RS8225000 | ||
| MeSH | Ozone | ||
| 性質 | |||
| 化學式 | O3 | ||
| 莫耳質量 | 47.998 [1] g·mol⁻¹ | ||
| 外觀 | 淺藍色氣體[1] | ||
| 密度 | 0.002144 g/cm3 (0 ℃) 0.001962g/cm3(25 ℃)[1] | ||
| 熔點 | -193 ℃[1] | ||
| 沸點 | -111.35 ℃[1] | ||
| 溶解性(水) | 1.05 g/dm3 (0 °C) | ||
| 折光度n D |
1.2226(液態) | ||
| 結構 | |||
| 空間群 | C2v | ||
| 配位幾何 | 對角線 | ||
| 分子構型 | 二面角 | ||
| 混成軌域 | sp2 for O1 | ||
| 偶極矩 | 0.53 D | ||
| 熱力學 | |||
| ΔfHm⦵298K | 142.67 kJ·mol−1 | ||
| S⦵298K | 238.92 J·mol-1·K-1 | ||
| 危險性 | |||
| 歐盟分類 | |||
| NFPA 704 | |||
| 相關物質 | |||
| 相關化學品 | 二氧化硫 三硫 一氧化二硫 環臭氧 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
臭氧(英語:ozone)即三氧(trioxygen,化學式:O3),是氧的單質三原子分子,是氧氣(雙氧)的同素異形體,在常溫下是一種有刺鼻味道的淡藍色氣體。臭氧的英語稱呼源自希臘語的中性現在時分詞 ozein (ὄζειν),意為「嗅」。
臭氧主要存在於距地球表面20公里的平流層下部的臭氧層中,含量約50ppm,主要由日光中的紫外線照射雙氧產生光解而成,少量由大氣層中的放電現象(閃電)電解產生。臭氧是一種比氧氣更活躍的氧化劑,能吸收對生物細胞和遺傳物質有害的短波紫外線,防止其到達地表。
發現
[編輯]1785年,德國人馬丁·范·馬倫在做實驗時,發現發電機附近有股異味,但是他並沒有繼續研究下去。[2]1839年,另一德裔瑞士化學家克里斯提安·弗里德里希·尚班在做電解水實驗亦發現特殊的臭味,[3]於是他以「ozone」來命名這種新氣體,來源自希臘語「ozein」,意思是「臭味」,並於1840年在《哲學雜誌》上發表相關他的發現。[4]
物理性質
[編輯]臭氧是一種淡藍色氣體,微溶於水,易溶於四氯化碳或碳氟化合物而顯藍色。在-112℃凝結成深藍色的液體。溫度低於-193℃,臭氧會形成紫黑色固體。
大多數人都可以嗅到有點類似氯刺鼻的氣味。暴露在0.1-1 ppm的臭氧會產生頭痛,眼睛灼熱,刺激呼吸道。即使空氣中有低濃度的臭氧,也會破壞有機材料,如橡膠、塑料,及動物的肺部組織。
性狀
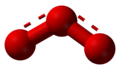
[編輯]臭氧具有等腰三角形結構,含有一個3中心4電子離域π鍵,三個氧原子分別位於三角形的三個頂點,頂角為116.79度,密度約為氧氣的1.5倍,其沸點和凝固點均高於氧。臭氧在液態時呈現藍紫色,在固態呈現紫色。[5]它與氧氣不同,高濃度的臭氧帶明顯令人噁心的氣味。但低濃度的臭氧聞起來就像下過雨後出門聞到的「新鮮空氣」的那種氣味,十分怡人。臭氧反應活性強,極易分解,很不穩定,在常溫下會逐漸分解為氧氣。臭氧性質比氧活潑,比重為一般空氣的1.7倍。臭氧會因光、熱、水份、金屬、金屬氧化物以及其他的觸媒而加速分解為氧。

它不溶於液態氧等。有很強的氧化性,在常溫下可將銀氧化成氧化銀,將硫化鉛氧化成硫酸鉛。臭氧可使許多有機色素褪色,對橡膠和纖維破壞性很大,很容易氧化有機不飽和化合物。臭氧在冰中極為穩定,其半衰期為2000年。
臭氧可利用碘化鉀來檢驗。
臭氧能迅速且定量地氧化I−
成I
2,此反應也可以用來測定O
3的含量。[6]
臭氧能氧化CN−
故常被用來處理電鍍工業中的含氰廢水[6] :
由於它的強氧化性,亦可用於消毒殺菌劑。[6]
結構
[編輯]
臭氧分子呈彎曲形對稱結構。中心原子採取sp²雜化(混成),兩個雜化軌道與其他兩個氧原子形成兩根σ鍵,另一雜化軌道容納孤對電子,除此之外,互相平行的2pz軌道重疊形成三中心四電子的大π鍵。
臭氧分子可以結合一個電子形成臭氧根離子(O3-),所形成的化合物為離子型臭氧化合物。臭氧分子也可以形成臭氧鏈-O-O-O-,構成共價型臭氧化物,如O3F2。[7]
臭氧層
[編輯]在大氣層中,氧分子因高能量的輻射而分解為氧原子(O),而氧原子與另一氧分子結合,即生成臭氧。臭氧又會與氧原子、氯或其他游離性物質反應而分解消失,由於這種反覆不斷的生成和消失,乃能使臭氧含量維持在一定的均衡狀態,而大氣中約有90%的臭氧存在於離地面15到50公里之間的區域,也就是平流層,在平流層的較低層,即離地面20到30公里處,為臭氧濃度最高之區域,是為臭氧層(ozone layer)。
臭氧層具有吸收太陽光中大部分的紫外線,起到保護地球表面生物不受紫外線侵害之功能;可解自由基,令生物RNA和DNA斷裂。
用途與制備
[編輯]工業上,用乾燥的空氣或氧氣,採用5-25kv的交流電壓進行無聲放電製取,用空氣做氧源時會衍生出大量氮氧化合氣體。目前最先進的臭氧製備方法為高能量紫外線光解空氣而對應生成純淨的臭氧。另外,在低溫下電解稀硫酸,或將液體氧氣加熱都可製得臭氧。大自然很容易產生臭氧,在打雷閃電時會產生幾十萬伏特的高壓電,電離空氣及有機物形成臭氧。臭氧能於短時間內將空氣中的浮游細菌消滅,並能中和、分解毒氣,去除惡臭。臭氧作為一種常溫下的氣態強氧化劑,能迅速瀰漫到整個滅菌空間,滅菌不留死角,殺菌更徹底。因此臭氧可用於淨化空氣及飲用水、殺菌、處理工業廢物和作為漂白劑。在一些游泳池以臭氧取代氯氣做為消毒用途。
市面上有一部分的空氣清淨機(或活氧機)具有製造活氧的功能,其實活氧就是臭氧,因為臭氧對生物有危害,在使用時人跟寵物都不能在室內。
三聚體的三過氧化三丙酮分解也可以產生臭氧,但反應較為劇烈,不宜使用:
臭氧的滅菌原理:滅菌過程屬生物化學氧化反應。臭氧能對細菌的細胞體直接氧化,即破壞其DNA而達到抑制的效果,對病毒的RNA亦有破壞作用;對各種毒素具有一定的氧化作用,降低其毒性。
- 臭氧能氧化分解細菌內部葡萄糖所需的酶,使細菌滅活死亡。
- 直接與細菌、病毒作用,破壞它們的細胞器和DNA、RNA,使細菌的新陳代謝受到破壞,導致細菌死亡。
- 透過細胞膜組織,侵入細胞內,作用於外膜的脂蛋白和內部的脂多糖,使細菌發生通透性畸變而溶解死亡。
臭氧對人體的影響
[編輯]臭氧具有強烈的刺激性,吸入過量對人體健康有一定危害。它主要是刺激和損害深部呼吸道,並可損害中樞神經系統,對眼睛有輕度的刺激作用。
臭氧吸入體內後,能迅速轉化為活性很強的自由基-超氧基(O₂⁻),主要使不飽和脂肪酸氧化,從而造成細胞損傷。[8]
當大氣中臭氧濃度為0.1mg/m3時,可引起鼻和喉頭黏膜的刺激;臭氧濃度在0.1-0.2mg/m3時,引起哮喘發作,導致上呼吸道疾病惡化,同時刺激眼睛,使視覺敏感度和視力降低[來源請求]。臭氧濃度在2mg/m3以上可引起頭痛、胸痛、思維能力下降,嚴重時可導致肺氣腫和肺水腫。
此外,臭氧還會阻礙血液輸氧功能,造成組織缺氧;使甲狀腺功能受損、骨骼鈣化,還可引起潛在性的全身影響,如誘發淋巴細胞染色體畸變,損害某些酶的活性和產生溶血反應。臭氧超過一定濃度,除對人體有一定毒害外,對某些植物生長也有一定危害。臭氧還可以使橡膠製品變脆和產生裂紋。臭氧對人體也有致畸性,母親孕期接觸臭氧可導致新生兒瞼裂狹小發生率增多。[9]
參見
[編輯]參考文獻
[編輯]- ^ 1.0 1.1 1.2 1.3 1.4 CRC Handbook of Chemistry and Physics 97th Edition. 2016-06-24: 4–77. ISBN 1-4987-5428-7 (英語).
- ^ 陳興漢; 廖品姍. 生物氧化醫學問與答. 台北: 漢珍. 2018-07-10. ISBN 9789869613583.
- ^ Schönbein, C. F. Lecture of 13 March 1839. Ber. Verh. Nat. Ges. Basel. 1838–1840, 4: 58.
- ^ Schönbein, C. F. On the Odour Accompanying Electricity and on the Probability of its Dependence on the Presence of a New Substance. Philosophical Magazine. 1840, 17: 293–294.
- ^ ChemicalForce. That's how liquid ozone explodes!. [2021-07-19]. (原始內容存檔於2022-01-27).
- ^ 6.0 6.1 6.2 武漢大學 吉林大學等校編 曹錫章 宋天佑 王杏喬修訂. 无机化学(第三版). 高等教育出版社. 1994-10: 573 [2017-10-22]. ISBN 978-7-04-004880-3 (中文).
- ^ 劉新錦等.無機元素化學 氧族元素.北京:科學出版社.2010.01 ISBN 978-7-03-026399-5
- ^ 王旭梅; 柳若安; 曹磊; 馮晶; 李燚佩; 孫建強. 《环境标志产品技术要求 食具消毒柜 (征求意见稿)》 编制说明 (PDF). 環境保護部環境發展中心(中日友好環境保護中心). 2017年9月 [2020-07-16]. (原始內容存檔 (PDF)於2020-07-16).
- ^ 《常見有毒化學品應急救援手冊》,中山大學出版社







