三氯化钕:修订间差异
小无编辑摘要 |
无编辑摘要 |
||
| (未显示2个用户的10个中间版本) | |||
| 第19行: | 第19行: | ||
| CASNo = 10024-93-8 |
| CASNo = 10024-93-8 |
||
| CASNo_Ref = {{cascite|correct|CAS}} |
| CASNo_Ref = {{cascite|correct|CAS}} |
||
| CASOther = <br> 13477-89- |
| CASOther = <br> 13477-89-9(水合物) |
||
| PubChem = 66204 |
| PubChem = 66204 |
||
}} |
}} |
||
|Section2={{Chembox Properties |
|Section2={{Chembox Properties |
||
| Formula = NdCl<sub>3</sub>,<br>NdCl<sub>3</sub>·6H<sub>2</sub> |
| Formula = NdCl<sub>3</sub>,<br>NdCl<sub>3</sub>·6H<sub>2</sub>O(水合物) |
||
| MolarMass = 250.598 |
| MolarMass = 250.598 |
||
| Appearance =紫色 |
| Appearance =紫色易[[潮解]]粉末 |
||
| Density = 4.13 g/cm<sup>3</sup> |
| Density = 4.13 g/cm<sup>3</sup>(水合物2.282) |
||
| Solubility = 0.967 kg/L at 13 °C |
| Solubility = 0.967 kg/L at 13 °C |
||
| SolubleOther = 0.445 kg/L |
| SolubleOther = 0.445 kg/L |
||
| 第36行: | 第36行: | ||
}} |
}} |
||
|Section3={{Chembox Structure |
|Section3={{Chembox Structure |
||
| Coordination = 三帽三棱柱配位构型<br /> |
| Coordination = 三帽三棱柱配位构型<br />(九配位) |
||
| CrystalStruct = [[六方晶系]] |
| CrystalStruct = [[六方晶系]]([[三氯化铀|UCl<sub>3</sub>]]结构),[[皮尔逊符号|hP8]] |
||
| SpaceGroup = P6<sub>3</sub>/m, No. 176 |
| SpaceGroup = P6<sub>3</sub>/m, No. 176 |
||
}} |
}} |
||
| 第50行: | 第50行: | ||
}} |
}} |
||
'''三氯化钕''' |
'''三氯化钕''',也称'''氯化钕''',是[[钕]]和[[氯]]两种元素组成的化合物,[[化学式]]为NdCl<sub>3</sub>。无水三氯化钕是为淡紫色固体,置于空气中会迅速吸水,变成紫色的[[水合物]]NdCl<sub>3</sub>·6H<sub>2</sub>O。三氯化钕是通过一种复杂的多级提取工艺从矿物[[独居石]]和{{link-en|氟碳铈矿|bastnäsite}}里提炼出来的。这种氯化物有多种重要应用,比如生产金属钕和金属钕基[[激光]]和[[光导纤维]]的化学中间体,其他应用包括有机合成和分解废水污染物的催化剂、[[铝]]及其合金的[[腐蚀]]防护剂、有机分子([[DNA]])[[荧光标记]]物。 |
||
== 外观 == |
== 外观 == |
||
[[File:NdCl3color.jpg|thumb|left|阳光下(上图)和荧光下(下图)的NdCl<sub>3</sub>]] |
[[File:NdCl3color.jpg|thumb|left|阳光下(上图)和荧光下(下图)的NdCl<sub>3</sub>]] |
||
NdCl<sub>3</sub>是一种淡紫色易[[潮解]]固体,吸收水蒸汽后变为紫色。生成的水合物像其他铷[[盐]]一样,在荧光下呈现不同的颜色,对于氯盐,呈现浅黄色(见图)<ref>{{cite book|page=523|title=Gems|author=Michael O'Donoghue, Robert Webster| url=http://books.google.com/?id=ZwcM5H-wHNoC&pg=PA523|publisher=Butterworth-Heinemann| year= 2006|isbn=0-7506-5856-8}}</ref>。颜色的变化最可能的成因是Nd<sup>3+</sup>通过[[电荷转移配合物|电荷转移]]变成Nd<sup>2+</sup>,Nd<sup>3+</sup>的橙光吸收带减弱,Nd<sup>2+</sup>的绿光吸收增强,产生了黄光<ref>{{cite journal|doi=10.1016/j.jallcom.2005.04.104|title=Electrochemically produced divalent neodymium in chloride melt|year=2006|author=Yamana, Hajimu|journal=Journal of Alloys and Compounds|volume=408–412|pages=66|last2=Park|first2=Byung Gi|last3=Shirai|first3=Osamu|last4=Fujii|first4=Toshiyuki|last5=Uehara|first5=Akihiro|last6=Moriyama|first6=Hirotake}}</ref><ref>{{cite journal|doi=10.1016/S0022-3093(02)01714-3|title=Intervalence charge transfer in neodymium–neodymium chloride melts: spectroscopic and electrical conductivity study|first5=Werner|last5=Freyland|first4=Detlef|last4=Nattland|first3=Frank|last3=Endres|first2=Sherif Zein|last2=El Abedin|year=2002|author=Terakado, O|journal=Journal of Non-Crystalline Solids|volume=312–314|pages=459}}</ref>。 |
NdCl<sub>3</sub>是一种淡紫色易[[潮解]]固体,吸收水蒸汽后变为紫色。生成的水合物像其他铷[[盐]]一样,在荧光下呈现不同的颜色,对于氯盐,呈现浅黄色(见图)<ref>{{cite book|page=523|title=Gems|author=Michael O'Donoghue, Robert Webster| url=http://books.google.com/?id=ZwcM5H-wHNoC&pg=PA523|publisher=Butterworth-Heinemann| year= 2006|isbn=0-7506-5856-8}}</ref>。颜色的变化最可能的成因是Nd<sup>3+</sup>通过[[电荷转移配合物|电荷转移跃迁]]变成Nd<sup>2+</sup>,Nd<sup>3+</sup>的橙光吸收带减弱,Nd<sup>2+</sup>的绿光吸收增强,产生了黄光<ref>{{cite journal|doi=10.1016/j.jallcom.2005.04.104|title=Electrochemically produced divalent neodymium in chloride melt|year=2006|author=Yamana, Hajimu|journal=Journal of Alloys and Compounds|volume=408–412|pages=66|last2=Park|first2=Byung Gi|last3=Shirai|first3=Osamu|last4=Fujii|first4=Toshiyuki|last5=Uehara|first5=Akihiro|last6=Moriyama|first6=Hirotake}}</ref><ref>{{cite journal|doi=10.1016/S0022-3093(02)01714-3|title=Intervalence charge transfer in neodymium–neodymium chloride melts: spectroscopic and electrical conductivity study|first5=Werner|last5=Freyland|first4=Detlef|last4=Nattland|first3=Frank|last3=Endres|first2=Sherif Zein|last2=El Abedin|year=2002|author=Terakado, O|journal=Journal of Non-Crystalline Solids|volume=312–314|pages=459}}</ref>。 |
||
== 结构 == |
== 结构 == |
||
=== 固体 === |
=== 固体 === |
||
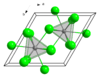
无水NdCl<sub>3</sub>为Nd九配位三帽三棱柱配位构型,具有类似[[三氯化铀|UCl<sub>3</sub>]]的[[六方晶系]]晶体结构。六方晶系结构常见于[[镧系元素]]和[[锕系元素]]的卤化物,如[[氯化镧|LaCl<sub>3</sub>]]、[[溴化镧|LaBr<sub>3</sub>]]、[[氯化钐|SmCl<sub>3</sub>]]、[[氯化镨|PrCl<sub>3</sub>]]、[[氯化铕|EuCl<sub>3</sub>]]、[[氯化铈|CeCl<sub>3</sub>]]、[[溴化铈|CeBr<sub>3</sub>]]、[[氯化钆|GdCl<sub>3</sub>]]、[[氯化镅|AmCl<sub>3</sub>]]和[[氯化铽|TbCl<sub>3</sub>]],但是[[氯化镱|YbCl<sub>3</sub>]] |
无水NdCl<sub>3</sub>为Nd九配位三帽三棱柱配位构型,具有类似[[三氯化铀|UCl<sub>3</sub>]]的[[六方晶系]]晶体结构。六方晶系结构常见于[[镧系元素]]和[[锕系元素]]的卤化物,如[[氯化镧|LaCl<sub>3</sub>]]、[[溴化镧|LaBr<sub>3</sub>]]、[[氯化钐|SmCl<sub>3</sub>]]、[[氯化镨|PrCl<sub>3</sub>]]、[[氯化铕|EuCl<sub>3</sub>]]、[[氯化铈|CeCl<sub>3</sub>]]、[[溴化铈|CeBr<sub>3</sub>]]、[[氯化钆|GdCl<sub>3</sub>]]、[[氯化镅|AmCl<sub>3</sub>]]和[[氯化铽|TbCl<sub>3</sub>]],但是[[氯化镱|YbCl<sub>3</sub>]]和[[氯化镥|LuCl<sub>3</sub>]]例外。<ref name=r1>{{cite book|author=F. T. Edelmann, P. Poremba|title=Synthetic Methods of Organometallic and Inorganic Chemistry Vol. 6 |editor=W. A. Herrmann|publisher=Georg Thieme Verlag| location= Stuttgart| year= 1997}}</ref> |
||
=== 溶液 === |
=== 溶液 === |
||
三氯化钕在溶液中的结构与溶剂密切相关,在水溶液中,主要成分是Nd(H<sub>2</sub>O)<sub>8</sub><sup>3+</sup>,大部分稀土元素的氯化物和溴化物都有类似情况。甲醇溶液中的主要成分是NdCl<sub>2</sub>(CH<sub>3</sub>OH)<sub>6</sub><sup>+</sup>,在[[盐酸]]溶液中,成分是NdCl(H<sub>2</sub>O)<sub>7</sub><sup>2+</sup>。各种情况下,钕均为八面體配位 |
三氯化钕在溶液中的结构与溶剂密切相关,在水溶液中,主要成分是[Nd(H<sub>2</sub>O)<sub>8</sub>]<sup>3+</sup>,大部分稀土元素的氯化物和溴化物都有类似情况。甲醇溶液中的主要成分是[NdCl<sub>2</sub>(CH<sub>3</sub>OH)<sub>6</sub>]<sup>+</sup>,在[[盐酸]]溶液中,成分是[NdCl(H<sub>2</sub>O)<sub>7</sub>]<sup>2+</sup>。各种情况下,钕均为八面體配位<ref>{{cite journal|doi=10.1021/ic50171a050|title=Solvent effects on the coordination of neodymium(3+) ions in concentrated neodymium trichloride solutions|year=1977|author=Steele, Marcus L.|journal=Inorganic Chemistry|volume=16|pages=1225|last2=Wertz|first2=David L.|issue=5}}</ref>。 |
||
== 性质 == |
== 性质 == |
||
NdCl<sub>3</sub>为软[[顺磁性]]固体,[[奈耳温度]]低至0.5 K,即温度低于0.5 K时,NdCl<sub>3</sub>变为[[铁磁性]]固体<ref>{{cite journal|doi=10.1016/0378-4363(77)90888-9|title=Analysis of magnetothermal parameters in NdCl3|year=1977|author=Skjeltorp, A|journal=Physica B+C|volume=86-88|pages=1295}}</ref>。NdCl<sub>3</sub>[[电导率]]为 240 S/m,[[热容]]为~100 J/(mol·K)<ref>{{cite book|url=http://books.google.com/?id=UWoEjb_BZFQC&pg=PA447|page=447|title=Molten Salts|author=R. T. Carlin| publisher=The Electrochemical Society|year= 1996|isbn=1-56677-159-5}}</ref>。 NdCl<sub>3</sub>易溶于水和[[乙醇]],不易溶于[[氯仿]]和[[乙醚]]。 NdCl<sub>3</sub>和金属Nd加热到650 °C,发生[[氧化还原反应]],生成NdCl<sub>2</sub> |
NdCl<sub>3</sub>为软[[顺磁性]]固体,[[奈耳温度]]低至0.5 K,即温度低于0.5 K时,NdCl<sub>3</sub>变为[[铁磁性]]固体<ref>{{cite journal|doi=10.1016/0378-4363(77)90888-9|title=Analysis of magnetothermal parameters in NdCl3|year=1977|author=Skjeltorp, A|journal=Physica B+C|volume=86-88|pages=1295}}</ref>。NdCl<sub>3</sub>[[电导率]]为 240 S/m,[[热容]]为~100 J/(mol·K)<ref>{{cite book|url=http://books.google.com/?id=UWoEjb_BZFQC&pg=PA447|page=447|title=Molten Salts|author=R. T. Carlin| publisher=The Electrochemical Society|year= 1996|isbn=1-56677-159-5}}</ref>。 NdCl<sub>3</sub>易溶于水和[[乙醇]],不易溶于[[氯仿]]和[[乙醚]]。 NdCl<sub>3</sub>和金属Nd加热到650 °C,发生[[氧化还原反应]],生成NdCl<sub>2</sub>:<ref>{{cite book|url=http://books.google.com/?id=bnS5elHL2w8C&pg=PA161| page=161|title=Synthesis of lanthanide and actinide compounds|author=Gerd Meyer, Lester R. Morss|publisher=Springer|year= 1991| isbn=0-7923-1018-7}}</ref> |
||
:2 NdCl<sub>3</sub> + Nd → 3 NdCl<sub>2</sub> |
:2 NdCl<sub>3</sub> + Nd → 3 NdCl<sub>2</sub> |
||
将NdCl<sub>3</sub>与水或[[二氧化硅]]共热可生成[[氯氧化钕]]NdOCl: |
|||
:NdCl<sub>3</sub> + H<sub>2</sub>O → NdOCl + 2 HCl |
:NdCl<sub>3</sub> + H<sub>2</sub>O → NdOCl + 2 HCl |
||
:2 NdCl<sub>3</sub> + SiO<sub>2</sub> → 2 NdOCl + SiCl<sub>4</sub> |
:2 NdCl<sub>3</sub> + SiO<sub>2</sub> → 2 NdOCl + SiCl<sub>4</sub> |
||
| 第83行: | 第83行: | ||
== 制备 == |
== 制备 == |
||
[[File:Monazit - Madagaskar.jpg|thumb|独居石]] |
[[File:Monazit - Madagaskar.jpg|thumb|独居石]] |
||
NdCl<sub>3</sub>可以从矿物独居石和氟碳铈矿制得。 |
NdCl<sub>3</sub>可以从矿物独居石和氟碳铈矿制得。制备过程非常复杂,因为地壳中钕元素的丰度很低,约38mg/kg,并且钕元素很难从镧系元素分离出来。由于矿物中钕元素比其他镧系元素含量高,质量分数高达16%,在镧系元素中居第三位,仅列[[铈]]和[[镧]]之后,因此制得钕的过程比其他镧系元素来得容易<ref name=history>{{cite book|url=http://books.google.com/?id=j-Xu07p3cKwC| pages= 268–270|title = Nature's building blocks: an A-Z guide to the elements| author =John Emsley| publisher= Oxford University Press| year = 2003| isbn = 0-19-850340-7}}</ref>。NdCl<sub>3</sub>工业制备过程简介如下: |
||
将矿石磨碎之后,用热的浓[[硫酸]]处理,生成水溶性的稀土硫酸盐。酸性滤液用[[氢氧化钠]]部分中和至pH值 |
将矿石磨碎之后,用热的浓[[硫酸]]处理,生成水溶性的稀土硫酸盐。酸性滤液用[[氢氧化钠]]部分中和至pH值为3-4。[[钍]]元素以氢氧化物的形式沉淀出来并去除,剩余的溶液以[[草酸铵]]处理,将稀土转化成不溶的[[草酸盐]]。退火之后,草酸盐变成氧化物。将氧化物溶于[[硝酸]],这样可除去一些主要成分铈,因为铈的氧化物(主要为[[二氧化铈]])不溶于硝酸。通过[[離子交換]]法,[[氧化釹]]从其他稀土元素的氧化物分离出来。此过程中,稀土离子与树脂中的氢离子、铵离子和铜离子交换,吸附到树脂上。然后用合适的络合剂,如[[柠檬酸铵]]和[[次氮基三乙酸盐]],将稀土离子选择性地洗出<ref name=patnaik>{{cite book | last =Patnaik | first =Pradyot | year = 2003 | title =Handbook of Inorganic Chemical Compounds | publisher = McGraw-Hill | pages = 444–446| isbn =0-07-049439-8 | url= http://books.google.com/?id=Xqj-TTzkvTEC&pg=PA243 | accessdate = 2009-06-06}}</ref>。 |
||
以上过程正常情况下得到产物[[三氧化二钕|Nd<sub>2</sub>O<sub>3</sub>]],这一氧化物难以转化成技术上所需的金属钕。因此,用[[盐酸]]或[[氯化铵]]处理这一氧化物,生成较不稳定的NdCl<sub>3</sub> |
以上过程正常情况下得到产物[[三氧化二钕|Nd<sub>2</sub>O<sub>3</sub>]],这一氧化物难以转化成技术上所需的金属钕。因此,用[[盐酸]]或[[氯化铵]]处理这一氧化物,生成较不稳定的NdCl<sub>3</sub>:<ref name=patnaik/> |
||
:Nd<sub>2</sub>O<sub>3</sub> + 6 NH<sub>4</sub>Cl → 2 NdCl<sub>3</sub> + 3 H<sub>2</sub>O + 6 NH<sub>3</sub> |
:Nd<sub>2</sub>O<sub>3</sub> + 6 NH<sub>4</sub>Cl → 2 NdCl<sub>3</sub> + 3 H<sub>2</sub>O + 6 NH<sub>3</sub> |
||
产物NdCl<sub>3</sub>迅速吸水,变成可以稳定储存的水合物NdCl<sub>3</sub>·6H<sub>2</sub>O,并且必要时可以变回NdCl<sub>3</sub>。简单加热NdCl<sub>3</sub>·6H<sub>2</sub>O不能得到NdCl<sub>3</sub>,因为会发生[[水解]],生成Nd<sub>2</sub>O<sub>3</sub><ref name=cat>{{cite book|url=http://books.google.com/?id=xX9mYOp2HFYC&pg=PA15|page=15|title=Neodymium based Ziegler catalysts| author=O. Nuyken, R. Anwander|publisher=Springer|year= 2006|isbn=3-540-34809-3}}</ref>。因此,需要特别的方法得到无水NdCl<sub>3</sub>,一个方法是在高真空环境下将NdCl<sub>3</sub>·6H<sub>2</sub>O与4-6当量的氯化铵缓慢升温到400 °C,另一方法是,与过量[[氯化亚砜]]一起加热数个小时<ref name=r1/><ref>{{cite journal|author= M. D. Taylor, P. C. Carter | journal=J. Inorg. Nucl. Chem.|volume=24 | page=387| year=1962|doi= 10.1016/0022-1902(62)80034-7|title= Preparation of anhydrous lanthanide halides, especially iodides|issue= 4}}</ref><ref>{{cite journal|author= J. Kutscher, A. Schneider| journal=Inorg. Nucl. Chem. Lett.|volume=7| page=815 | year=1971|doi= 10.1016/0020-1650(71)80253-2|title= Notiz zur Präparation von wasserfreien Lanthaniden-Haloge-niden, Insbesondere von Jodiden|issue= 9}}</ref><ref>{{cite journal|author= J. H. Freeman, M. L. Smith| journal=J. Inorg. Nucl. Chem.|title=The preparation of anhydrous inorganic chlorides by dehydration with thionyl chloride |volume=7| page= 224 | year=1958|doi=10.1016/0022-1902(58)80073-1|issue= 3}}</ref>。 |
产物NdCl<sub>3</sub>迅速吸水,变成可以稳定储存的水合物NdCl<sub>3</sub>·6H<sub>2</sub>O,并且必要时可以变回NdCl<sub>3</sub>。简单加热NdCl<sub>3</sub>·6H<sub>2</sub>O不能得到NdCl<sub>3</sub>,因为会发生[[水解]],生成Nd<sub>2</sub>O<sub>3</sub><ref name=cat>{{cite book|url=http://books.google.com/?id=xX9mYOp2HFYC&pg=PA15|page=15|title=Neodymium based Ziegler catalysts| author=O. Nuyken, R. Anwander|publisher=Springer|year= 2006|isbn=3-540-34809-3}}</ref>。因此,需要特别的方法得到无水NdCl<sub>3</sub>,一个方法是在高真空环境下将NdCl<sub>3</sub>·6H<sub>2</sub>O与4-6当量的氯化铵缓慢升温到400 °C,另一方法是,与过量[[氯化亚砜]]一起加热数个小时<ref name=r1/><ref>{{cite journal|author= M. D. Taylor, P. C. Carter | journal=J. Inorg. Nucl. Chem.|volume=24 | page=387| year=1962|doi= 10.1016/0022-1902(62)80034-7|title= Preparation of anhydrous lanthanide halides, especially iodides|issue= 4}}</ref><ref>{{cite journal|author= J. Kutscher, A. Schneider| journal=Inorg. Nucl. Chem. Lett.|volume=7| page=815 | year=1971|doi= 10.1016/0020-1650(71)80253-2|title= Notiz zur Präparation von wasserfreien Lanthaniden-Haloge-niden, Insbesondere von Jodiden|issue= 9}}</ref><ref>{{cite journal|author= J. H. Freeman, M. L. Smith| journal=J. Inorg. Nucl. Chem.|title=The preparation of anhydrous inorganic chlorides by dehydration with thionyl chloride |volume=7| page= 224 | year=1958|doi=10.1016/0022-1902(58)80073-1|issue= 3}}</ref>。 |
||
NdCl<sub>3</sub>还可以由金属钕与盐酸或[[氯]]反应制备,但是金属钕成本很高,因此这一方法不够经济,只能用于研究。制备完成之后,产物在高真空高温下[[升华]]提纯。<ref name=r1/><ref>{{cite journal|author= L. F. Druding, J. D. Corbett| journal=J. Am. Chem. Soc.|volume=83| page=2462 | year=1961|doi= 10.1021/ja01472a010|title=Lower Oxidation States of the Lanthanides. Neodymium(II) Chloride and Iodide|issue= 11}}</ref><ref>{{cite journal|author= J. D. Corbett| journal=Rev. Chim. Minerale|volume=10| page=239|year=1973}}</ref> |
NdCl<sub>3</sub>还可以由金属钕与盐酸或[[氯]]反应制备,但是金属钕成本很高,因此这一方法不够经济,只能用于实验室研究。制备完成之后,产物在高真空高温下[[升华]]提纯。<ref name=r1/><ref>{{cite journal|author= L. F. Druding, J. D. Corbett| journal=J. Am. Chem. Soc.|volume=83| page=2462 | year=1961|doi= 10.1021/ja01472a010|title=Lower Oxidation States of the Lanthanides. Neodymium(II) Chloride and Iodide|issue= 11}}</ref><ref>{{cite journal|author= J. D. Corbett| journal=Rev. Chim. Minerale|volume=10| page=239|year=1973}}</ref> |
||
== 应用 == |
== 应用 == |
||
=== 制备金属钕 === |
=== 制备金属钕 === |
||
[[File:Powerlite NdYAG.jpg|thumb|Nd:YAG激光器发出波长为532nm倍频绿光]] |
[[File:Powerlite NdYAG.jpg|thumb|Nd:YAG激光器发出波长为532nm倍频绿光]] |
||
氯化钕是制备金属钕的起始化合物。在真空或氩气气氛下,NdCl<sub>3</sub>与[[氯化铵]]或[[氟化铵]]和[[氢氟酸]]或碱金属或碱土金属加热到300-400°C,可得金属钕 |
氯化钕是制备金属钕的起始化合物。在真空或氩气气氛下,NdCl<sub>3</sub>与[[氯化铵]]或[[氟化铵]]和[[氢氟酸]]一起加热,或与碱金属或碱土金属加热到300-400°C,可得金属钕 |
||
:NdCl<sub>3</sub> + 3 Li → Nd + 3 LiCl |
:NdCl<sub>3</sub> + 3 Li → Nd + 3 LiCl |
||
另一个制备方法是在约700°C的温度下,[[电解]]无水NdCl<sub>3</sub>与[[NaCl]]或[[KCl]]组成的熔融混合物<ref>{{cite book|url=http://books.google.com/?id=E1npz8pwmYwC&pg=PA276|page=276| title=Extractive metallurgy of rare earths|author=C. K. Gupta, Nagaiyar Krishnamurthy|publisher=CRC Press|year= 2004|isbn=0-415-33340-7}}</ref>。 |
另一个制备方法是在约700°C的温度下,[[电解]]无水NdCl<sub>3</sub>与[[NaCl]]或[[KCl]]组成的熔融混合物<ref>{{cite book|url=http://books.google.com/?id=E1npz8pwmYwC&pg=PA276|page=276| title=Extractive metallurgy of rare earths|author=C. K. Gupta, Nagaiyar Krishnamurthy|publisher=CRC Press|year= 2004|isbn=0-415-33340-7}}</ref>。 |
||
| 第115行: | 第115行: | ||
=== 催化剂 === |
=== 催化剂 === |
||
NdCl<sub>3</sub>与其他有机物如{{link-en|三乙基铝|triethylaluminium}} |
NdCl<sub>3</sub>与其他有机物如{{link-en|三乙基铝|triethylaluminium}}或[[2-丙醇]]等结合可用作[[齐格勒-纳塔催化剂]],加快各种[[二烯烃]]的[[聚合]]反应,产物包括通用合成橡胶,如[[聚丁烯]]、[[顺丁橡胶]]和[[聚异戊二烯]]<ref name=cat/><ref>{{cite journal|doi=10.1016/0032-3950(91)90237-K|title=Lanthanide compounds—Catalysts of stereospecific polymerization of diene monomers. Review☆|year=1991|author=Marina, N|journal=Polymer Science U S S R|volume=33|pages=387|last2=Monakov|first2=Y|last3=Sabirov|first3=Z|last4=Tolstikov|first4=G|issue=3}}</ref><ref>{{cite journal|author= C. Wang|journal=Materials Chemistry and Physics|volume=89|page= 116|year=200|title=In situ cyclization modification in polymerization of butadiene by rare earth coordination catalyst|doi=10.1016/j.matchemphys.2004.08.038}}</ref>。 |
||
三氯化钕还用于[[二氧化钛]]改性。二氧化钛是最常见的无机[[光催化剂]],可用于分解废水污染物如[[苯酚]]和各种[[染料]]。二氧化钛的催化反应必须用[[紫外光]]触发。而如果二氧化钛修饰上NdCl<sub>3</sub>,在日光等可见光下也可以有催化功能。NdCl<sub>3</sub>改性的二氧化钛可通过化学共沉淀-胶溶方法从TiCl<sub>4</sub>和NdCl<sub>3</sub>混合物的水溶液制备。这一工艺在商业上用在光催化自清洁涂料的1000升规模的反应器上。<ref>{{cite journal|doi=10.1016/S0169-4332(03)00945-0|title=Photocatalysis of neodymium ion modified TiO2 sol under visible light irradiation|year=2004|author=Xie, Y|journal=Applied Surface Science|volume=221|pages=17 }}</ref><ref>{{cite journal|doi=10.1016/j.matchemphys.2008.09.025|title=Preparation and photocatalytic activity of rare earth doped TiO2 nanoparticles|year=2009|author=Stengl, V|journal=Materials Chemistry and Physics|volume=114|pages=217|last2=Bakardjieva|first2=S|last3=Murafa|first3=N}}</ref> |
三氯化钕还用于[[二氧化钛]]改性。二氧化钛是最常见的无机[[光催化剂]],可用于催化分解废水污染物如[[苯酚]]和各种[[染料]]。二氧化钛的催化反应必须用[[紫外光]]触发。而如果二氧化钛修饰上NdCl<sub>3</sub>,在日光等可见光下也可以有催化功能。NdCl<sub>3</sub>改性的二氧化钛可通过化学共沉淀-胶溶方法从TiCl<sub>4</sub>和NdCl<sub>3</sub>混合物的水溶液制备。这一工艺在商业上用在光催化自清洁涂料的1000升规模的反应器上。<ref>{{cite journal|doi=10.1016/S0169-4332(03)00945-0|title=Photocatalysis of neodymium ion modified TiO2 sol under visible light irradiation|year=2004|author=Xie, Y|journal=Applied Surface Science|volume=221|pages=17 }}</ref><ref>{{cite journal|doi=10.1016/j.matchemphys.2008.09.025|title=Preparation and photocatalytic activity of rare earth doped TiO2 nanoparticles|year=2009|author=Stengl, V|journal=Materials Chemistry and Physics|volume=114|pages=217|last2=Bakardjieva|first2=S|last3=Murafa|first3=N}}</ref> |
||
=== 防腐蚀 === |
=== 防腐蚀 === |
||
| 第128行: | 第128行: | ||
== 毒性 == |
== 毒性 == |
||
三氯化钕对人和动物没有明显毒性,其毒性与食盐相差不大。三氯化钕对动物的[[半数致死量]]LD<sub>50</sub> (能杀死一半试验样品的剂量)为3.7 g每千克体重(小鼠口服),或0.15 g/ |
三氯化钕对人和动物没有明显毒性,其毒性与食盐相差不大。三氯化钕对动物的[[半数致死量]]LD<sub>50</sub> (能杀死一半试验样品的剂量)为3.7 g每千克体重(小鼠口服),或0.15 g/kg(兔,静脉注射)。连续24小时接触500毫克,对皮肤有轻微刺激(兔{{link-en|眼刺激试验|Draize test}})。<ref>{{cite web|url=http://www.americanelements.com/ndcl.html|title=Neodymium Chloride|accessdate=2009-07-07}}</ref><ref>{{cite web|url=https://secure.strem.com/catalog/printer.php?type=msds&catalog_number=93-6022| title=MSDS|accessdate=2009-07-07}}</ref>LD<sub>50</sub>大于2 g/kg可认为无毒<ref>{{cite book|page=385|url=http://books.google.com/?id=imMJJP5T5rsC&pg=PA385|title=Borates| author=Donald E. Garrett|year=1998|publisher= Academic Press| isbn=978-0-12-276060-0}}</ref>。 |
||
== 参见 == |
== 参见 == |
||
2015年2月12日 (四) 16:06的版本
| 三氯化钕 | |||
|---|---|---|---|
| |||
| 别名 | 氯化钕 Neodymium trichloride | ||
| 识别 | |||
| CAS号 | 10024-93-8 13477-89-9(水合物) | ||
| PubChem | 66204 | ||
| ChemSpider | 59589 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | ATINCSYRHURBSP-DFZHHIFOAM | ||
| 性质 | |||
| 化学式 | NdCl3, NdCl3·6H2O(水合物) | ||
| 摩尔质量 | 250.598 g·mol⁻¹ | ||
| 外观 | 紫色易潮解粉末 | ||
| 密度 | 4.13 g/cm3(水合物2.282) | ||
| 熔点 | 758 °C(1031 K) | ||
| 沸点 | 1600 °C(1873 K) | ||
| 溶解性(水) | 0.967 kg/L at 13 °C | ||
| 溶解性(乙醇) | 0.445 kg/L | ||
| 结构 | |||
| 晶体结构 | 六方晶系(UCl3结构),hP8 | ||
| 空间群 | P63/m, No. 176 | ||
| 配位几何 | 三帽三棱柱配位构型 (九配位) | ||
| 危险性 | |||
| MSDS | External MSDS | ||
| 欧盟编号 | Not listed | ||
| 相关物质 | |||
| 其他阴离子 | 三溴化钕 三氧化二釹 | ||
| 其他阳离子 | LaCl3, SmCl3, PrCl3, EuCl3, CeCl3, GdCl3, TbCl3, TbCl3 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
三氯化钕,也称氯化钕,是钕和氯两种元素组成的化合物,化学式为NdCl3。无水三氯化钕是为淡紫色固体,置于空气中会迅速吸水,变成紫色的水合物NdCl3·6H2O。三氯化钕是通过一种复杂的多级提取工艺从矿物独居石和氟碳铈矿里提炼出来的。这种氯化物有多种重要应用,比如生产金属钕和金属钕基激光和光导纤维的化学中间体,其他应用包括有机合成和分解废水污染物的催化剂、铝及其合金的腐蚀防护剂、有机分子(DNA)荧光标记物。
外观

NdCl3是一种淡紫色易潮解固体,吸收水蒸汽后变为紫色。生成的水合物像其他铷盐一样,在荧光下呈现不同的颜色,对于氯盐,呈现浅黄色(见图)[1]。颜色的变化最可能的成因是Nd3+通过电荷转移跃迁变成Nd2+,Nd3+的橙光吸收带减弱,Nd2+的绿光吸收增强,产生了黄光[2][3]。
结构
固体
无水NdCl3为Nd九配位三帽三棱柱配位构型,具有类似UCl3的六方晶系晶体结构。六方晶系结构常见于镧系元素和锕系元素的卤化物,如LaCl3、LaBr3、SmCl3、PrCl3、EuCl3、CeCl3、CeBr3、GdCl3、AmCl3和TbCl3,但是YbCl3和LuCl3例外。[4]
溶液
三氯化钕在溶液中的结构与溶剂密切相关,在水溶液中,主要成分是[Nd(H2O)8]3+,大部分稀土元素的氯化物和溴化物都有类似情况。甲醇溶液中的主要成分是[NdCl2(CH3OH)6]+,在盐酸溶液中,成分是[NdCl(H2O)7]2+。各种情况下,钕均为八面體配位[5]。
性质
NdCl3为软顺磁性固体,奈耳温度低至0.5 K,即温度低于0.5 K时,NdCl3变为铁磁性固体[6]。NdCl3电导率为 240 S/m,热容为~100 J/(mol·K)[7]。 NdCl3易溶于水和乙醇,不易溶于氯仿和乙醚。 NdCl3和金属Nd加热到650 °C,发生氧化还原反应,生成NdCl2:[8]
- 2 NdCl3 + Nd → 3 NdCl2
- NdCl3 + H2O → NdOCl + 2 HCl
- 2 NdCl3 + SiO2 → 2 NdOCl + SiCl4
NdCl3与硫化氢在约1100 °C的高温下反应,生成硫化釹Nd2S3:
- 2 NdCl3 + 3 H2S → 2 Nd2S3 + 6 HCl
NdCl3在高温下与氨气或磷化氢反应,分别生成氮化钕NdN和磷化钕NdP:
- NdCl3 + NH3 → NdN + 3 HCl
- NdCl3 + PH3 → NdP + 3 HCl
- NdCl3 + 3 HF → NdF3 + 3 HCl
制备

NdCl3可以从矿物独居石和氟碳铈矿制得。制备过程非常复杂,因为地壳中钕元素的丰度很低,约38mg/kg,并且钕元素很难从镧系元素分离出来。由于矿物中钕元素比其他镧系元素含量高,质量分数高达16%,在镧系元素中居第三位,仅列铈和镧之后,因此制得钕的过程比其他镧系元素来得容易[10]。NdCl3工业制备过程简介如下:
将矿石磨碎之后,用热的浓硫酸处理,生成水溶性的稀土硫酸盐。酸性滤液用氢氧化钠部分中和至pH值为3-4。钍元素以氢氧化物的形式沉淀出来并去除,剩余的溶液以草酸铵处理,将稀土转化成不溶的草酸盐。退火之后,草酸盐变成氧化物。将氧化物溶于硝酸,这样可除去一些主要成分铈,因为铈的氧化物(主要为二氧化铈)不溶于硝酸。通过離子交換法,氧化釹从其他稀土元素的氧化物分离出来。此过程中,稀土离子与树脂中的氢离子、铵离子和铜离子交换,吸附到树脂上。然后用合适的络合剂,如柠檬酸铵和次氮基三乙酸盐,将稀土离子选择性地洗出[9]。
以上过程正常情况下得到产物Nd2O3,这一氧化物难以转化成技术上所需的金属钕。因此,用盐酸或氯化铵处理这一氧化物,生成较不稳定的NdCl3:[9]
- Nd2O3 + 6 NH4Cl → 2 NdCl3 + 3 H2O + 6 NH3
产物NdCl3迅速吸水,变成可以稳定储存的水合物NdCl3·6H2O,并且必要时可以变回NdCl3。简单加热NdCl3·6H2O不能得到NdCl3,因为会发生水解,生成Nd2O3[11]。因此,需要特别的方法得到无水NdCl3,一个方法是在高真空环境下将NdCl3·6H2O与4-6当量的氯化铵缓慢升温到400 °C,另一方法是,与过量氯化亚砜一起加热数个小时[4][12][13][14]。
NdCl3还可以由金属钕与盐酸或氯反应制备,但是金属钕成本很高,因此这一方法不够经济,只能用于实验室研究。制备完成之后,产物在高真空高温下升华提纯。[4][15][16]
应用
制备金属钕

氯化钕是制备金属钕的起始化合物。在真空或氩气气氛下,NdCl3与氯化铵或氟化铵和氢氟酸一起加热,或与碱金属或碱土金属加热到300-400°C,可得金属钕
- NdCl3 + 3 Li → Nd + 3 LiCl
另一个制备方法是在约700°C的温度下,电解无水NdCl3与NaCl或KCl组成的熔融混合物[17]。
激光和光纤放大器
NdCl3本身冷发光性能不强[18],但是它可以为Nd:YAG激光和掺钕光纤放大器等各种发光材料提供Nd3+离子。Nd-YAG激光器发射波长为1.064微米的红外光,是最常见的固体激光器(即工作物质为固体的激光器)。这些发光材料中用NdCl3而不是金属钕或其氧化物的原因是,加工光纤时化学气相沉积工艺中NdCl3易于沉积,化学气相沉积是光纤生长中广泛使用的工艺[19]。
三氯化钕不仅用作传统的石英光纤的掺杂剂,还用作塑料光纤(聚酰亚胺、聚乙烯等)的掺杂剂[20]。NdCl3还用作红外有机发光二极管的添加剂[21][22]。除此之外,掺钕薄膜不仅能用作LED,还能做滤光片,改善LED的发射光谱[23]。
利用NdCl3(和其他稀土盐)在各种溶剂中的溶解性,可制造一种新型的稀土激光器,这种激光器的工作物质不是固体而是液体,液体中的Nd3+离子可由以下反应制备:
- SnCl4 + 2 SeOCl2 → SnCl62− + 2 SeOCl+
- SbCl5 + SeOCl2 → SbCl62− + SeOCl+
- 3 SeOCl+ + NdCl3 → Nd3+(solv) + 3 SeOCl2,
其中,Nd3+其实是溶剂化离子,被几个氧氯化硒包围的球,即[Nd(SeOCl2)m]3+。这一方法制备的液体激光材料同样发生波长为1.064微米的红外光,具有高增益和单色性强等性质,性质更类似晶体钕激光器的特点,而非玻璃钕激光器的特点。这样的液体激光器的量子效率是传统Nd:YAG激光器的0.75倍[21]。
催化剂
NdCl3与其他有机物如三乙基铝或2-丙醇等结合可用作齐格勒-纳塔催化剂,加快各种二烯烃的聚合反应,产物包括通用合成橡胶,如聚丁烯、顺丁橡胶和聚异戊二烯[11][24][25]。
三氯化钕还用于二氧化钛改性。二氧化钛是最常见的无机光催化剂,可用于催化分解废水污染物如苯酚和各种染料。二氧化钛的催化反应必须用紫外光触发。而如果二氧化钛修饰上NdCl3,在日光等可见光下也可以有催化功能。NdCl3改性的二氧化钛可通过化学共沉淀-胶溶方法从TiCl4和NdCl3混合物的水溶液制备。这一工艺在商业上用在光催化自清洁涂料的1000升规模的反应器上。[26][27]
防腐蚀
据文献报道,铝或铝合金表面涂上三氯化钕,放置于NaCl溶液中两个月,不见一点腐蚀痕迹。这种防腐涂层可以将铝或铝合金浸没于NdCl3水溶液数周制得,或者在NdCl3水溶液中电镀制得。与铬等传统阻蚀剂相比,NdCl3和其他稀土盐对环境更友好,对人类和动物毒性更低。[28][29]
NdCl3在铝合金表面生成了不溶的的不溶的氢氧化钕,因此对铝合金有保护作用。NdCl3作为一种氯化物,本身是一种腐蚀剂,有时用以做陶瓷材料腐蚀试验。[30]
标记有机分子
包括钕在内的镧系元素有强的发光性能,广泛用作荧光标记物。DNA等有机分子被NdCl3标记后,非常易于在荧光显微镜下示踪[21]。
毒性
三氯化钕对人和动物没有明显毒性,其毒性与食盐相差不大。三氯化钕对动物的半数致死量LD50 (能杀死一半试验样品的剂量)为3.7 g每千克体重(小鼠口服),或0.15 g/kg(兔,静脉注射)。连续24小时接触500毫克,对皮肤有轻微刺激(兔眼刺激试验)。[31][32]LD50大于2 g/kg可认为无毒[33]。
参见
参考文献
- ^ Michael O'Donoghue, Robert Webster. Gems. Butterworth-Heinemann. 2006: 523. ISBN 0-7506-5856-8.
- ^ Yamana, Hajimu; Park, Byung Gi; Shirai, Osamu; Fujii, Toshiyuki; Uehara, Akihiro; Moriyama, Hirotake. Electrochemically produced divalent neodymium in chloride melt. Journal of Alloys and Compounds. 2006,. 408–412: 66. doi:10.1016/j.jallcom.2005.04.104.
- ^ Terakado, O; El Abedin, Sherif Zein; Endres, Frank; Nattland, Detlef; Freyland, Werner. Intervalence charge transfer in neodymium–neodymium chloride melts: spectroscopic and electrical conductivity study. Journal of Non-Crystalline Solids. 2002,. 312–314: 459. doi:10.1016/S0022-3093(02)01714-3.
- ^ 4.0 4.1 4.2 F. T. Edelmann, P. Poremba. W. A. Herrmann , 编. Synthetic Methods of Organometallic and Inorganic Chemistry Vol. 6. Stuttgart: Georg Thieme Verlag. 1997.
- ^ Steele, Marcus L.; Wertz, David L. Solvent effects on the coordination of neodymium(3+) ions in concentrated neodymium trichloride solutions. Inorganic Chemistry. 1977, 16 (5): 1225. doi:10.1021/ic50171a050.
- ^ Skjeltorp, A. Analysis of magnetothermal parameters in NdCl3. Physica B+C. 1977, 86–88: 1295. doi:10.1016/0378-4363(77)90888-9.
- ^ R. T. Carlin. Molten Salts. The Electrochemical Society. 1996: 447. ISBN 1-56677-159-5.
- ^ Gerd Meyer, Lester R. Morss. Synthesis of lanthanide and actinide compounds. Springer. 1991: 161. ISBN 0-7923-1018-7.
- ^ 9.0 9.1 9.2 Patnaik, Pradyot. Handbook of Inorganic Chemical Compounds. McGraw-Hill. 2003: 444–446 [2009-06-06]. ISBN 0-07-049439-8.
- ^ John Emsley. Nature's building blocks: an A-Z guide to the elements. Oxford University Press. 2003: 268–270. ISBN 0-19-850340-7.
- ^ 11.0 11.1 O. Nuyken, R. Anwander. Neodymium based Ziegler catalysts. Springer. 2006: 15. ISBN 3-540-34809-3.
- ^ M. D. Taylor, P. C. Carter. Preparation of anhydrous lanthanide halides, especially iodides. J. Inorg. Nucl. Chem. 1962, 24 (4): 387. doi:10.1016/0022-1902(62)80034-7.
- ^ J. Kutscher, A. Schneider. Notiz zur Präparation von wasserfreien Lanthaniden-Haloge-niden, Insbesondere von Jodiden. Inorg. Nucl. Chem. Lett. 1971, 7 (9): 815. doi:10.1016/0020-1650(71)80253-2.
- ^ J. H. Freeman, M. L. Smith. The preparation of anhydrous inorganic chlorides by dehydration with thionyl chloride. J. Inorg. Nucl. Chem. 1958, 7 (3): 224. doi:10.1016/0022-1902(58)80073-1.
- ^ L. F. Druding, J. D. Corbett. Lower Oxidation States of the Lanthanides. Neodymium(II) Chloride and Iodide. J. Am. Chem. Soc. 1961, 83 (11): 2462. doi:10.1021/ja01472a010.
- ^ J. D. Corbett. Rev. Chim. Minerale. 1973, 10: 239. 缺少或
|title=为空 (帮助) - ^ C. K. Gupta, Nagaiyar Krishnamurthy. Extractive metallurgy of rare earths. CRC Press. 2004: 276. ISBN 0-415-33340-7.
- ^ B. Henderson, Ralph H. Bartram. Crystal field engineering of solid state laser materials. Cambridge University Press. 2000: 211. ISBN 0-521-59349-2.
- ^ Emil Wolf. Progress in Optics. Elsevier. 1993: 49. ISBN 0-444-81592-9.
- ^ Wong, W; Liu, K; Chan, K; Pun, E. Polymer devices for photonic applications. Journal of Crystal Growth. 2006, 288: 100. doi:10.1016/j.jcrysgro.2005.12.017.
- ^ 21.0 21.1 21.2 Comby, S; Bunzli, J. Handbook on the Physics and Chemistry of Rare Earths Volume 37. Handbook on the Physics and Chemistry of Rare Earths 37: 217. 2007. ISBN 978-0-444-52144-6. doi:10.1016/S0168-1273(07)37035-9.
|chapter=被忽略 (帮助) - ^ Oriordan, A; Vandeun, R; Mairiaux, E; Moynihan, S; Fias, P; Nockemann, P; Binnemans, K; Redmond, G. Synthesis of a neodymium-quinolate complex for near-infrared electroluminescence applications. Thin Solid Films. 2008, 516 (15): 5098. doi:10.1016/j.tsf.2007.11.112.
- ^ Cho, Y.; Choi, Y. K.; Sohn, S. H. Optical properties of neodymium-containing polymethylmethacrylate films for the organic light emitting diode color filter. Applied Physics Letters. 2006, 89 (5): 051102. doi:10.1063/1.2244042.
- ^ Marina, N; Monakov, Y; Sabirov, Z; Tolstikov, G. Lanthanide compounds—Catalysts of stereospecific polymerization of diene monomers. Review☆. Polymer Science U S S R. 1991, 33 (3): 387. doi:10.1016/0032-3950(91)90237-K.
- ^ C. Wang. In situ cyclization modification in polymerization of butadiene by rare earth coordination catalyst. Materials Chemistry and Physics. 200, 89: 116. doi:10.1016/j.matchemphys.2004.08.038.
- ^ Xie, Y. Photocatalysis of neodymium ion modified TiO2 sol under visible light irradiation. Applied Surface Science. 2004, 221: 17. doi:10.1016/S0169-4332(03)00945-0.
- ^ Stengl, V; Bakardjieva, S; Murafa, N. Preparation and photocatalytic activity of rare earth doped TiO2 nanoparticles. Materials Chemistry and Physics. 2009, 114: 217. doi:10.1016/j.matchemphys.2008.09.025.
- ^ Vinod S. Agarwala, G. M. Ugiansky. New methods for corrosion testing of aluminum alloys. ASTM International. 1992: 180. ISBN 0-8031-1435-4.
- ^ Bethencourt, M; Botana, F.J.; Calvino, J.J.; Marcos, M.; Rodríguez-Chacón, M.A. Lanthanide compounds as environmentally-friendly corrosion inhibitors of aluminium alloys: a review. Corrosion Science. 1998, 40 (11): 1803. doi:10.1016/S0010-938X(98)00077-8.
- ^ Takeuchi, M; Kato, T; Hanada, K; Koizumi, T; Aose, S. Corrosion resistance of ceramic materials in pyrochemical reprocessing condition by using molten salt for spent nuclear oxide fuel. Journal of Physics and Chemistry of Solids. 2005, 66 (2–4): 521. doi:10.1016/j.jpcs.2004.06.046.
- ^ Neodymium Chloride. [2009-07-07].
- ^ MSDS. [2009-07-07].
- ^ Donald E. Garrett. Borates. Academic Press. 1998: 385. ISBN 978-0-12-276060-0.