亞硝基化合物
外觀
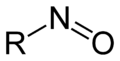


亞硝基化合物 (nitroso compounds)指含有亞硝基(-NO,nitroso)官能團的一類有機化合物,在有機化學上其中有NO基團連接到該有機部分。通式為RNO。
這樣,各種亞硝基可以被歸類為:
- C-亞硝基化合物(如,亞硝基烷烴;R-N=O),
- S-亞硝基化合物(硝基硫醇;RS-N=O),
- N-亞硝基化合物(如,亞硝胺,R1N(-R2)-N=O),
- O-型亞硝基化合物(烷基亞硝酸鹽; RO-N=O)。
亞硝是包含NO基團的非有機化合物,例如通過N-原子直接結合至該金屬,給予金屬-NO基團。可替代地一個非金屬的例子是常見的試劑亞硝酰氯(Cl-N=O)。一氧化氮是一種穩定的自由基,具有未配對電子。
還原一氧化氮給出低亞硝酸陰離子,NO−:
- NO + e− → NO−
NO氧化產生的亞硝離子,NO+:
- NO → NO+ + e−
亞硝作為配體
[編輯]
一氧化氮可以作為複合物的配體。所產生的配合物被稱為金屬亞硝,並且可以結合到金屬原子在兩個極端的模式:為NO+與NO−。它一般認為NO+坐標線性,在M−N−O角度為180°,而NO− 形成彎曲的幾何形狀,具有大約120℃的M−N−O角度。然而許多研究的結果表明,NO配位體的離子的描述不與金屬-NO幾何形狀相關。
有機亞硝基化合物
[編輯]亞硝基化合物可由硝基化合物的還原或羥胺衍生物的氧化得到,如製備2-甲基-2-亞硝基丙烷((CH3)3CNO,t-BuNO)時,採用的路線為:[1]
- (CH3)3CNH2 → (CH3)3CNO2
- (CH3)3CNO2 → (CH3)3CNHOH
- (CH3)3CNHOH → (CH3)3CNO
- Fischer-Hepp重排反應中,以亞硝胺作原料合成相應的對亞硝基苯胺類化合物。
- Barton反應中,亞硝酸酯光解生成δ-亞硝基醇。
亞硝化與亞硝基化
[編輯]根據物理化學環境,亞硝酸鹽可進入兩種反應。
- 亞硝基化是增加一個亞硝酰離子NO−到一個金屬(例如鐵)或硫醇,形成亞硝基鐵 Fe-NO(例如,亞硝基血紅素)或亞硝基硫醇。
- 亞硝化是增加一個亞硝離子NO+到胺-NH2 形成亞硝胺。這種轉換發生在酸性的pH下,尤其是在胃中,如下面示出的方程式,苯基亞硝胺的形成:
- NO2− + H+ HONO
- HONO + H+ H2O + NO+
- C6H5NH2 + NO+ → C6H5N(H)NO + H+
許多伯烷基亞硝基化合物,如CH3N(H)NO,相對於水解為醇傾向於不穩定。那些從仲胺衍生的則更加堅固。正是這些亞硝胺是在囓齒動物致癌。
食物
[編輯]

氮循環(英語:Nitrogen cycle)是描述自然界中氮單質和含氮化合物之間相互轉換過程的生態系統的物質循環。
在食物和在胃腸道,亞硝化和亞硝基化不會對消費者健康產生同樣的後果。
- 在醃燻肉:肉通過醃燻化處理會含有亞硝酸鹽,以及pH在5左右,其中幾乎所有的亞硝酸鹽以NO2− (99%)形式存在。醃燻肉也加入抗壞血酸鈉(或異抗壞血酸或維生素C)。抗壞血酸抑制胺的亞硝化成亞硝胺,因為抗壞血酸與NO2−反應生成NO。抗壞血酸和pH值5有利於血紅素鐵亞硝基化,形成亞硝基血紅素,它包含於肌紅蛋白內時呈現為紅色,當它烹煮時被釋放呈現為粉紅色。它使醃燻肉呈現「培根味」:因此亞硝基血紅素被認為對肉類行業和消費者有好處。
- 在蔬菜中:硝酸鹽在蔬菜中本來已經存在,植物吸收利用的氮素是無機態的硝酸態氮素(NO3-)和銨態氮(NH4+)。尿素、動物皮粉、豆餅等氮肥經過細菌分解成硝酸態氮和銨態氮後被作物吸收利用。硝酸鹽本身並無毒性,但進入人體後,它一部分會在口腔內由唾液中的微生物轉變成亞硝酸鹽,另外一部分會被胃腸中的微生物還原成亞硝酸鹽。亞硝酸鹽可在人體內與其他食品、次級胺(Secondary amines)等反應,可形成致癌性很強的化學物質亞硝基化合物。
- 在胃中:分泌氯化氫使胃呈酸性環境(pH值為2)和攝入亞硝酸鹽(與食物或唾液)導致胺的亞硝化,能產生亞硝胺(潛在致癌物)。如果胺濃度低,亞硝化反應低(例如,低蛋白飲食,無發酵食品)或者高濃度維他命C(例如,量高的水果飲食)。然後形成亞硝基硫醇,它在pH2是穩定的。
- 在大腸:中性pH值不利於亞硝化。甚至加入2級胺或亞硝酸鹽後,形成的糞便沒有亞硝胺。中性pH值有利於從亞硝基硫醇釋放NO−,和鐵的亞硝基化。從紅色肉類餵養志願者大便中發現亞硝基化合物,基本上是non-N-nitroso ATNC (Apparent Total Nitroso Compounds), 例如,亞硝基硫醇和亞硝基鐵(如亞硝基血紅素)。
參見
[編輯]參考資料
[編輯]- ^ A. Calder, A. R. Forrester, and S. P. Hepburn 2-Methyl-2-nitrosopropane and Its Dimer Organic Syntheses, Coll. Vol. 6, p.803; Vol. 52, p.77. Link (頁面存檔備份,存於互聯網檔案館)

