亚硝基化合物
外观
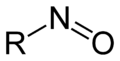


亚硝基化合物 (nitroso compounds)指含有亚硝基(-NO,nitroso)官能团的一类有机化合物,在有机化学上其中有NO基团连接到该有机部分。通式为RNO。
这样,各种亚硝基可以被归类为:
- C-亚硝基化合物(如,亚硝基烷烃;R-N=O),
- S-亚硝基化合物(硝基硫醇;RS-N=O),
- N-亚硝基化合物(如,亚硝胺,R1N(-R2)-N=O),
- O-型亚硝基化合物(烷基亚硝酸盐; RO-N=O)。
亚硝是包含NO基团的非有机化合物,例如通过N-原子直接结合至该金属,给予金属-NO基团。可替代地一个非金属的例子是常见的试剂亚硝酰氯(Cl-N=O)。一氧化氮是一种稳定的自由基,具有未配对电子。
还原一氧化氮给出低亚硝酸阴离子,NO−:
- NO + e− → NO−
NO氧化产生的亚硝离子,NO+:
- NO → NO+ + e−
亚硝作为配体
[编辑]
一氧化氮可以作为复合物的配体。所产生的配合物被称为金属亚硝,并且可以结合到金属原子在两个极端的模式:为NO+与NO−。它一般认为NO+坐标线性,在M−N−O角度为180°,而NO− 形成弯曲的几何形状,具有大约120℃的M−N−O角度。然而许多研究的结果表明,NO配位体的离子的描述不与金属-NO几何形状相关。
有机亚硝基化合物
[编辑]亚硝基化合物可由硝基化合物的还原或羟胺衍生物的氧化得到,如制备2-甲基-2-亚硝基丙烷((CH3)3CNO,t-BuNO)时,采用的路线为:[1]
- (CH3)3CNH2 → (CH3)3CNO2
- (CH3)3CNO2 → (CH3)3CNHOH
- (CH3)3CNHOH → (CH3)3CNO
- Fischer-Hepp重排反应中,以亚硝胺作原料合成相应的对亚硝基苯胺类化合物。
- Barton反应中,亚硝酸酯光解生成δ-亚硝基醇。
亚硝化与亚硝基化
[编辑]根据物理化学环境,亚硝酸盐可进入两种反应。
- 亚硝基化是增加一个亚硝酰离子NO−到一个金属(例如铁)或硫醇,形成亚硝基铁 Fe-NO(例如,亚硝基血红素)或亚硝基硫醇。
- 亚硝化是增加一个亚硝离子NO+到胺-NH2 形成亚硝胺。这种转换发生在酸性的pH下,尤其是在胃中,如下面示出的方程式,苯基亚硝胺的形成:
- NO2− + H+ HONO
- HONO + H+ H2O + NO+
- C6H5NH2 + NO+ → C6H5N(H)NO + H+
许多伯烷基亚硝基化合物,如CH3N(H)NO,相对于水解为醇倾向于不稳定。那些从仲胺衍生的则更加坚固。正是这些亚硝胺是在啮齿动物致癌。
食物
[编辑]

氮循环(英语:Nitrogen cycle)是描述自然界中氮单质和含氮化合物之间相互转换过程的生态系统的物质循环。
在食物和在胃肠道,亚硝化和亚硝基化不会对消费者健康产生同样的后果。
- 在腌熏肉:肉通过腌熏化处理会含有亚硝酸盐,以及pH在5左右,其中几乎所有的亚硝酸盐以NO2− (99%)形式存在。腌熏肉也加入抗坏血酸钠(或异抗坏血酸或维生素C)。抗坏血酸抑制胺的亚硝化成亚硝胺,因为抗坏血酸与NO2−反应生成NO。抗坏血酸和pH值5有利于血红素铁亚硝基化,形成亚硝基血红素,它包含于肌红蛋白内时呈现为红色,当它烹煮时被释放呈现为粉红色。它使腌熏肉呈现“培根味”:因此亚硝基血红素被认为对肉类行业和消费者有好处。
- 在蔬菜中:硝酸盐在蔬菜中本来已经存在,植物吸收利用的氮素是无机态的硝酸态氮素(NO3-)和铵态氮(NH4+)。尿素、动物皮粉、豆饼等氮肥经过细菌分解成硝酸态氮和铵态氮后被作物吸收利用。硝酸盐本身并无毒性,但进入人体后,它一部分会在口腔内由唾液中的微生物转变成亚硝酸盐,另外一部分会被胃肠中的微生物还原成亚硝酸盐。亚硝酸盐可在人体内与其他食品、次级胺(Secondary amines)等反应,可形成致癌性很强的化学物质亚硝基化合物。
- 在胃中:分泌氯化氢使胃呈酸性环境(pH值为2)和摄入亚硝酸盐(与食物或唾液)导致胺的亚硝化,能产生亚硝胺(潜在致癌物)。如果胺浓度低,亚硝化反应低(例如,低蛋白饮食,无发酵食品)或者高浓度维他命C(例如,量高的水果饮食)。然后形成亚硝基硫醇,它在pH2是稳定的。
- 在大肠:中性pH值不利于亚硝化。甚至加入2级胺或亚硝酸盐后,形成的粪便没有亚硝胺。中性pH值有利于从亚硝基硫醇释放NO−,和铁的亚硝基化。从红色肉类喂养志愿者大便中发现亚硝基化合物,基本上是non-N-nitroso ATNC (Apparent Total Nitroso Compounds), 例如,亚硝基硫醇和亚硝基铁(如亚硝基血红素)。
参见
[编辑]参考资料
[编辑]- ^ A. Calder, A. R. Forrester, and S. P. Hepburn 2-Methyl-2-nitrosopropane and Its Dimer Organic Syntheses, Coll. Vol. 6, p.803; Vol. 52, p.77. Link (页面存档备份,存于互联网档案馆)

