六甲苯
| 六甲苯 | |
|---|---|
| |
| |

| |
| IUPAC名 Hexamethylbenzene | |
| 別名 | 1,2,3,4,5,6-六甲基苯 六甲基苯 |
| 識別 | |
| CAS號 | 87-85-4 |
| PubChem | 6908 |
| ChemSpider | 6642 |
| SMILES |
|
| InChI |
|
| InChIKey | YUWFEBAXEOLKSG-UHFFFAOYAF |
| ChEBI | 39001 |
| 性質 | |
| 化學式 | C12H18 |
| 摩爾質量 | 162.27 g·mol−1 |
| 外觀 | 白色晶體 |
| 密度 | 1.0630 g cm−3 |
| 熔點 | 164.9-166.3 °C(438-439 K) |
| 沸點 | 265.2 °C(538 K) |
| 溶解性(水) | 不溶 |
| 溶解性 | 乙酸、丙酮、苯、氯仿、乙醚和乙醇 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
六甲苯是一種碳氫化合物,化學式 C12H18,結構式 C6(CH3)6。它是由苯的六個氫原子都被甲基取代而生的化合物。1929年,嘉芙蓮·朗斯代爾報告了六甲苯的晶體結構,證明苯環是平面六邊形的[1],從而結束了關於苯的結構的持續爭論。無論是對於X射線晶體學抑或研究芳香性的領域,這皆是一個具有歷史意義的成果。[2][3]
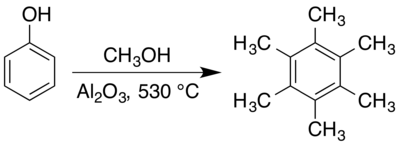
六甲苯可以通過苯酚與甲醇在高溫和合適的固體催化劑(如氧化鋁)下反應而生成。[4][5][6]這個反應的反應機理已被廣泛研究,[7][8][9][10] 過程中含有幾種反應中間體的存在。[6][11][12]在合適的催化劑存在下[13][14],二甲基乙炔的炔烴三聚也可生成六甲基苯。[15]六甲基苯可以被氧化成苯六甲酸,[16]後者的鋁鹽存在於稀有礦物蜜蠟石中。[17] 六甲基苯也是有機金屬化合物中的一種配體。[18]其中一個例子是隨着釕原子氧化態變化而改變結構的有機釕化合物,[19][20]而這個變化不存在於對應的有機鐵化合物中。[19]
2016年,《應用化學》[21]報告了六甲基苯雙陽離子的晶體結構。顯示出的結構為五角錐形,其中一個碳原子與其他六個碳原子具有鍵合相互作用。[22][23]這個結構是「空前未見的」,[21]因為碳通常的最高化合價是四,而這也吸引了《新科學人》、[22]《化學化工新聞》[23]和《科學新聞》等的注意。[24]這種結構並沒有違反八隅體規則,因為這些碳-碳鍵不是兩電子鍵。此結構在教學上可作為例子,說明碳原子「可以與四個以上的原子直接結合」。[24]斯蒂芬·巴哈拉赫證明了六甲基苯雙陽離子是超配位的,而不是超價分子,並解釋了其芳香性。[25]此類物種中的鍵合可以從有機金屬化學的視角描述,此想法在1975年提出,[26]緊隨C
6(CH
3)2+
6的發現。[27][28][29]
性質
[編輯]六甲苯是一種芳香化合物,有六個π電子(符合休克爾規則)離域於整個環狀平面系統之上;六個環碳原子之中的每一個都是sp2 雜化並展現出平面三角形分子構型,而每一個甲基碳皆是sp3雜化並有着四面體形分子構型,與其經驗結構的描述一致。[1]六甲苯是一種無色到白色,正交晶系的晶體,[30]熔點 165–166 °C,[5]沸點 268 °C,密度1.0630 g cm−3。[30]它不溶於水,但溶於有機溶劑,例如苯和乙醇。[30]
礦物蜜蠟石是苯六甲酸的鋁鹽的水合物,化學式 Al
2[C
6(CO
2)
6]•16H
2O。[17]苯六甲酸本身可以從礦物中提取,[31]隨着還原反應而產生六甲苯。相反,六甲苯也可以被氧化成苯六甲酸:[16]

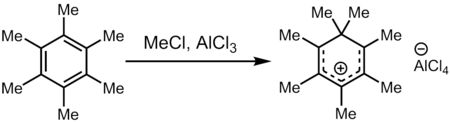
六甲苯和氯甲烷、三氯化鋁的超級親電混合物(Meδ⊕Cl---δ⊖AlCl3的來源)會產生七甲苯陽離子,是最早被直接觀察到的碳正離子之一。
結構
[編輯]在1927年,嘉芙蓮·朗斯代爾利用克里斯托夫·英果爾德提供的六甲苯晶體測定其晶體結構。[3] 她將X射線繞射分析結果發表在《自然》期刊上[32]。朗斯代爾在《晶體與X射線》(Crystals and X-Rays)一書中描述了該項研究,[33]解釋指她意識到儘管六甲苯的單元格是三斜晶系,但其繞射圖案具有偽六邊形對稱性,這使得結構的可能性受到限制,足以讓她通過試錯法來產生結構模型。[3]這項工作明確表明六甲苯是平面分子構型的,並且環內不同的碳-碳鍵距離皆為相同,[2]為理解芳香性的性質提供重要證據。
製備
[編輯]1880年,約瑟夫·阿希耶·勒貝勒和威廉·H·葛林報告了[34]一個被形容為「不平凡」的,由氯化鋅催化的一鍋合成法,過程中從甲醇合成了六甲苯。[35]在催化劑的熔點下 (283 °C),反應的吉布斯能 (ΔG) 為 −1090 kJ mol−1,反應如下:[35]
- 15 CH
3OH → C
6(CH
3)
6 + 3 CH
4 + 15 H
2O
勒貝勒和葛林提出了理論以解釋這個過程,內容涉及由甲醇脫水而成的亞甲基單元的芳香化,從而生成苯環,接着在原位用氯甲烷進行完全的傅-克甲基化。[35]反應主要產生飽和烴的混合物,六甲苯為次要產物。[36]六甲苯也是對二甲苯傅-克烷基化成均四甲苯的副產物,而通過烷基化均四甲苯或五甲苯產生的六甲苯皆有着可觀產率。[37]
六甲苯通常在高溫氣相中通過固體催化劑下製備。早期製備六甲苯的方法包括使丙酮和甲醇蒸氣的混合物在400 °C的氧化鋁催化劑下反應。[38]苯酚和甲醇在 410–440 °C 的乾燥二氧化碳氣體中也會產生六甲苯,[4]儘管它是作為苯甲醚(甲氧基苯)、甲酚(甲基苯酚)和其他甲基化苯酚的複雜混合物的一部分而被生成。[11]在《有機合成》收錄的制備方法中,甲醇和苯酚則在 530 °C的氧化鋁催化劑下反應,產率約為66%,[5]而在其他不同條件下進行的合成方法也有被報道。[6]
這種表面介導反應的機制已被妥善地研究,研究的過程中着眼於如何更好地控制反應結果,[8][39]特別是在尋找具有選擇性和受控的鄰位甲基化反應。[9][10][40][41]苯甲醚[11]和五甲苯[6]皆被報告為此過程的反應中間體。華倫汀·科普秋格和同事發現,六甲基環己二烯酮的異構體(2,3,4,4,5,6- 和 2,3,4,5,6,6-)亦是反應中的中間體,經過重排反應而形成六甲苯。[7][12]
2-丁炔三聚也可以生成六甲苯。[15]此反應可被三苯基三(四氫呋喃)鉻[13]或四氯化鈦與三異丁基鋁的配合物催化。[14]

用處
[編輯]六甲苯可用作3He-NMR 光譜測試的溶劑。[42]
反應
[編輯]它亦會被三氟過氧乙酸或過氧化氫氧化,產生 2,3,4,5,6,6-六甲基-2,4-環己二烯酮:[44][7][12]

就像苯本身一樣,六甲苯中富含電子的芳香系統使其能在有機金屬化學中充當配體。[18] 甲基是推電子基,使得相對於苯,它將中心環的鹼性提高六到七個數量級。[45]有各種金屬中心的這些配合物已被報告,包括鈷、[46]鉻、[13]鐵、[19]錸、[47]銠、[46]釕[20]和鈦。[14]鈷和銠和六甲苯化學式 [M(C
6(CH
3)
6)
2]n+ (M = Co, Fe, Rh, Ru; n = 1, 2) 的夾心配合物陽離子,其中金屬中心和兩個芳烴的π電子結合,並且可以通過配體交換從適當的金屬鹽輕鬆合成,例如:[46]
- CoBr
2 + 2 AlBr
3 → [Co(C
6(CH
3)
6)
2]2+
+ 2 AlBr−
4
這些配合物可以參與氧化還原反應。銠和鈷配合物的雙陽離子可以用合適的活性金屬(鈷配合物用鋁還原,銠配合物用鋅還原)進行單電子還原,描述鈷配合物的反應方程式如下:[46]
- 3 [Co(C
6(CH
3)
6)
2]2+
+ Al → 3 [Co(C
6(CH
3)
6)
2]+
+ Al3+

左:n = 2, [RuII(η6-C6(CH3)6)2]2+
右:n = 0, [Ru0(η4-C6(CH3)6)(η6-C6(CH3)6)]
為清楚起見省略了甲基。與碳-釕鍵合相關的電子對是紅色的
在有機釕化學中,雙陽離子和電中性物種在乙腈中的還原電位為 −1.02 V,[19]並且伴隨着結構的變化。[20][48]隨着釕中心氧化態的變化,其中一個六甲苯配體的哈普托數會變化。[Ru(η6-C6(CH3)6)2]2+ 會還原成 [Ru(η4-C6(CH3)6)(η6-C6(CH3)6)],[20]它的結構變化是用來遵守18電子規則,增強穩定性。
類似的鐵(II)配合物的單電子還原可逆(在乙醇水溶液中為−0.48 V),但雙電子還原(−1.46 V)不可逆,[19]表明它的結構變化不同於在釕配合物中發現的結構變化。
雙陽離子
[編輯]
6(CH
3)2+
6的錐型碳陽離子
C
6(CH
3)
6H+
在1960年代對六甲基杜瓦苯的調查中首次報道,[49]基於核磁共振的證據提出了五角錐結構,[50]隨後得到無序的[21]晶體結構數據的支持。[51]1970年代初期,由赫普克·霍赫芬領導的理論工作預測了五角錐形的雙陽離子 C
6(CH
3)2+
6的存在,並且該意見很快得到了實驗證據的支持。[27][28][29]對苯在極低溫度(低於 4K)下的雙電子氧化的光譜學研究表明,形成六邊形的雙陽離子,然後迅速重新排列成五角錐結構:[52]
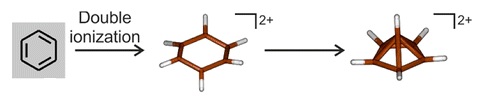

6(CH
3)2+
6有五角錐結構
一般預料六甲苯的雙電子氧化會令其重排為錐型碳陽離子,但以此方法試圖批量合成的嘗試皆沒有成功。[21]然而,在2016年霍赫芬的方法受到了改進,連帶得出了[C
6(CH
3)
6][SbF
6]
2•HSO
3F的高質素晶體結構。它的錐高為 1.18 埃格斯特朗,五個甲基都略高於底面,[21]形成反轉的四面體構型。它的製備方法是六甲基杜瓦苯的環氧化物和魔酸反應,離去氧離子 (O2−
),形成雙陽離子:[21]

儘管先前的間接光譜證據和理論計算均已表明它們的存在,但對於『帶有一個僅與其他碳原子結合的六配位碳』的特殊化學物種所做的分離和結構測定仍是前所未有的,[21]並吸引了《化學化工新聞》、[23]《新科學人》、[22]《科學新聞》[24]和ZME Science評論。[53]碳的化合價為四,而該例角錐頂點上的那個碳原子和六個原子鍵合,並不尋常。[23]該分子是芳香性的,在五角錐的底部與其頂點之間的五個鍵中總共只有六個電子,可以避免違反八隅體規則。也就是說,五角錐的每個斜邊只有部分鍵,而不是一個正常的共價鍵。儘管頂部的碳確實與六個原子鍵合,但它總共使用不超過八個電子。[26]
注意形成雙陽離子五角錐斜邊的弱鍵(在結構中顯示為虛線),它的鍵級約為 0.54,因此總鍵級為 5 × 0.54 + 1 = 3.7 < 4,所以此物種不是超價分子,但它是超配位分子。[25]雙陽離子中,有三種不同的碳-碳鍵,一則環上的鍵,具有芳香性;二則環到甲基的單鍵;三則斜邊,是弱的部分鍵。其差異也反映在碳-碳鍵長中:環的碳-碳鍵長為 1.439–1.445 Å(最短),環到甲基的碳-碳鍵長為 1.479–1.489 Å(居中),而環到六配位碳的碳-碳鍵長為1.694–1.715 Å(最長)[21]。從有機金屬化學的角度來看,該物種可以被視為 [(η5
–C
5(CH
3)
5)C(CH
3)]
。[26]此理解下,碳(IV)的中心 (C4+
),與一個芳香性的 η5–環戊二烯陰離子(六個電子)和甲基陰離子(兩個電子)鍵結,從而滿足八隅體規則,類似於相關的氣相有機鋅化合物 [(η5
–C
5(CH
3)
5)Zn(CH
3)] ,其有同樣的配體鍵結到鋅(II)中心(Zn2+
),符合18電子規則。[54][55]
對其評論指出「雖然我們被教導碳只能有四個朋友,但碳其實可以與四個以上的原子相關聯,這一點非常重要」,評論並補充指「從我們一般認為碳-碳鍵是雙電子鍵的想法出發,碳原子並不會形成六個鍵。」[24]「這一切都是關於讓化學家為無奇不有而感到驚訝的挑戰和可能性。」[22]
參考資料
[編輯]- ^ 1.0 1.1 Lonsdale, Kathleen. The Structure of the Benzene Ring in Hexamethylbenzene. Proc. R. Soc. A. 1929, 123 (792): 494–515. doi:10.1098/rspa.1929.0081
 .
.
- ^ 2.0 2.1 Lydon, John. A Welcome to Leeds (PDF). Newsletter of the History of Physcis Group. January 2006, (19): 8–11 [2021-08-29]. (原始內容存檔 (PDF)於2017-01-09).
- ^ 3.0 3.1 3.2 Lydon, John. Letters (PDF). Newsletter of the History of Physcis Group. July 2006, (20): 34–35 [2021-08-29]. (原始內容存檔 (PDF)於2015-09-06).
- ^ 4.0 4.1 Briner, E.; Plüss, W.; Paillard, H. Recherches sur la déshydration catalytique des systèmes phénols-alcools [Research on the catalytic dehydration of phenol-alcohol systems]. Helv. Chim. Acta. 1924, 7 (1): 1046–1056. doi:10.1002/hlca.192400701132 (法語).
- ^ 5.0 5.1 5.2 (1955) "Hexamethylbenzene". Org. Synth. 35: 73; Coll. Vol. 4: 520.
- ^ 6.0 6.1 6.2 6.3 Landis, Phillip S.; Haag, Werner O. Formation of Hexamethylbenzene from Phenol and Methanol. J. Org. Chem. 1963, 28 (2): 585. doi:10.1021/jo01037a517.
- ^ 7.0 7.1 7.2 Krysin, A. P.; Koptyug, V. A. Reaction of phenols with alcohols on aluminum oxide II. The mechanism of hexamethylbenzene formation from phenol and methyl alcohol. Russ. Chem. Bull. 1969, 18 (7): 1479–1482. doi:10.1007/BF00908756.
- ^ 8.0 8.1 Ipatiew, W.; Petrow, A. D. Über die katalytische Kondensation von Aceton bei hohen Temperaturen und Drucken. (I. Mitteilung) [On the catalytic condensation of acetone at high temperatures and pressures. (I. Communication)]. Ber. Dtsch. Chem. Ges. A/B. 1926, 59 (8): 2035–2038. doi:10.1002/cber.19260590859 (德語).
- ^ 9.0 9.1 Kotanigawa, Takeshi; Yamamoto, Mitsuyoshi; Shimokawa, Katsuyoshi; Yoshida, Yuji. Methylation of Phenol over Metallic Oxides. Bulletin of the Chemical Society of Japan. 1971, 44 (7): 1961–1964. doi:10.1246/bcsj.44.1961
 .
.
- ^ 10.0 10.1 Kotanigawa, Takeshi. Mechanisms for the Reaction of Phenol with Methanol over the ZnO–Fe2O3 Catalyst. Bull. Chem. Soc. Jpn. 1974, 47 (4): 950–953. doi:10.1246/bcsj.47.950
 .
.
- ^ 11.0 11.1 11.2 Cullinane, N. M.; Chard, S. J. 215. The action of methanol on phenol in the presence of alumina. Formation of anisole, methylated phenols, and hexamethylbenzene. J. Chem. Soc. 1945: 821–823. PMID 21008356. doi:10.1039/JR9450000821.
- ^ 12.0 12.1 12.2 Shubin, V. G.; Chzhu, V. P.; Korobeinicheva, I. K.; Rezvukhin, A. I.; Koptyug, V. A. UV, IR, AND PMR spectra of hydroxyhexamethylbenzenonium ions. Russ. Chem. Bull. 1970, 19 (8): 1643–1648. doi:10.1007/BF00996497.
- ^ 13.0 13.1 13.2 Zeiss, H. H.; Herwig, W. Acetylenic π-complexes of chromium in organic synthesis. J. Am. Chem. Soc. 1958, 80 (11): 2913. doi:10.1021/ja01544a091.
- ^ 14.0 14.1 14.2 Franzus, B.; Canterino, P. J.; Wickliffe, R. A. Titanium tetrachloride–trialkylaluminum complex—A cyclizing catalyst for acetylenic compounds. J. Am. Chem. Soc. 1959, 81 (6): 1514. doi:10.1021/ja01515a061.
- ^ 15.0 15.1 Weber, S. R.; Brintzinger, H. H. Reactions of Bis(hexamethylbenzene)iron(0) with Carbon Monoxide and with Unsaturated Hydrocarbons. J. Organomet. Chem. 1977, 127 (1): 45–54. doi:10.1016/S0022-328X(00)84196-0. hdl:2027.42/22975
 .
.
- ^ 16.0 16.1 Wibaut, J. P.; Overhoff, J.; Jonker, E. W.; Gratama, K. On the preparation of mellitic acid from hexa-methylbenzene and on the hexachloride of mellitic acid. Recl. Trav. Chim. Pays-Bas. 1941, 60 (10): 742–746. doi:10.1002/recl.19410601005.
- ^ 17.0 17.1 Wenk, Hans-Rudolf; Bulakh, Andrey. Organic Minerals. Minerals – Their Constitution and Origin 2nd. Cambridge University Press. 2016 [2021-08-29]. ISBN 9781316423684. (原始內容存檔於2022-03-14).
- ^ 18.0 18.1 Pampaloni, Guido. Aromatic hydrocarbons as ligands. Recent advances in the synthesis, the reactivity and the applications of bis(η6-arene) complexes. Coord. Chem. Rev. 2010, 254 (5–6): 402–419. doi:10.1016/j.ccr.2009.05.014.
- ^ 19.0 19.1 19.2 19.3 19.4 Kotz, John C. The Electrochemistry of Transition Metal Organometallic Compounds. Fry, Albert J.; Britton, Wayne E. (編). Topics in Organic Electrochemistry. Springer Science & Business Media. 1986: 83–176 [2021-08-29]. ISBN 9781489920348. (原始內容存檔於2021-08-29).
- ^ 20.0 20.1 20.2 20.3 20.4 Huttner, Gottfried; Lange, Siegfried; Fischer, Ernst O. Molecular Structure of Bis(Hexamethylbenzene)Ruthenium(0). Angew. Chem. Int. Ed. Engl. 1971, 10 (8): 556–557. doi:10.1002/anie.197105561.
- ^ 21.0 21.1 21.2 21.3 21.4 21.5 21.6 21.7 Malischewski, Moritz; Seppelt, Konrad. Crystal Structure Determination of the Pentagonal-Pyramidal Hexamethylbenzene Dication C6(CH3)62+. Angew. Chem. Int. Ed. 2017, 56 (1): 368–370. PMID 27885766. doi:10.1002/anie.201608795.
- ^ 22.0 22.1 22.2 22.3 Boyle, Rebecca. Carbon seen bonding with six other atoms for the first time. New Scientist. 14 January 2017, (3108) [14 January 2017]. (原始內容存檔於2017-01-16).
- ^ 23.0 23.1 23.2 23.3 Ritter, Stephen K. Six bonds to carbon: Confirmed. Chem. Eng. News. 19 December 2016, 94 (49): 13 [2021-08-29]. doi:10.1021/cen-09449-scicon007. (原始內容存檔於2017-01-09).
- ^ 24.0 24.1 24.2 24.3 Hamers, Laurel. Carbon can exceed four-bond limit. Science News. 24 December 2016, 190 (13): 17 [2021-08-29]. (原始內容存檔於2017-02-03).
- ^ 25.0 25.1 25.2 Bachrach, Steven M. A six-coordinate carbon atom. comporgchem.com. 17 January 2017 [18 January 2017]. (原始內容存檔於2017-01-19).
- ^ 26.0 26.1 26.2 Hogeveen, Hepke; Kwant, Peter W. Pyramidal mono- and dications. Bridge between organic and organometallic chemistry. Acc. Chem. Res. 1975, 8 (12): 413–420. doi:10.1021/ar50096a004.
- ^ 27.0 27.1 Hogeveen, Hepke; Kwant, Peter W. Direct observation of a remarkably stable dication of unusual structure: (CCH3)62⊕. Tetrahedron Lett. 1973, 14 (19): 1665–1670. doi:10.1016/S0040-4039(01)96023-X.
- ^ 28.0 28.1 Hogeveen, Hepke; Kwant, Peter W.; Postma, J.; van Duynen, P. Th. Electronic spectra of pyramidal dications, (CCH3)62+ and (CCH)62+. Tetrahedron Lett. 1974, 15 (49–50): 4351–4354. doi:10.1016/S0040-4039(01)92161-6.
- ^ 29.0 29.1 Hogeveen, Hepke; Kwant, Peter W. Chemistry and spectroscopy in strongly acidic solutions. XL. (CCH3)62+, an unusual dication. J. Am. Chem. Soc. 1974, 96 (7): 2208–2214. doi:10.1021/ja00814a034.
- ^ 30.0 30.1 30.2 Haynes, William M. (編). CRC Handbook of Chemistry and Physics 93rd. CRC Press. 2016. p. 3-296 [2021-08-29]. ISBN 9781439880500. (原始內容存檔於2022-04-27).
- ^ Liebig, Justus. Lectures on organic chemistry: delivered during the winter session, 1844, in the University of Giessen. The Lancet. 1844, 2 (1106): 190–192 [2021-08-29]. doi:10.1016/s0140-6736(02)64759-2. (原始內容存檔於2021-08-29).
- ^ Lonsdale, Kathleen. The Structure of the Benzene Ring. Nature. 1928, 122 (810): 810. S2CID 4105837. doi:10.1038/122810c0.
- ^ Lonsdale, Kathleen. Crystals and X-Rays. George Bell & Sons. 1948.
- ^ Le Bel, Joseph Achille; Greene, William H. On the decomposition of alcohols, etc., by zinc chloride at high temperatures. American Chemical Journal. 1880, 2: 20–26.
- ^ 35.0 35.1 35.2 Chang, Clarence D. Hydrocarbons from Methanol. Catal. Rev. - Sci. Eng. 1983, 25 (1): 1–118. doi:10.1080/01614948308078874.
- ^ Olah, George A.; Doggweiler, Hans; Felberg, Jeff D.; Frohlich, Stephan; Grdina, Mary Jo; Karpeles, Richard; Keumi, Takashi; Inaba, Shin-ichi; Ip, Wai M.; Lammertsma, Koop; Salem, George; Tabor, Derrick. Onium Ylide chemistry. 1. Bifunctional acid-base-catalyzed conversion of heterosubstituted methanes into ethylene and derived hydrocarbons. The onium ylide mechanism of the C1→C2 conversion. J. Am. Chem. Soc. 1984, 106 (7): 2143–2149. doi:10.1021/ja00319a039.
- ^ Smith (1930). "Durene". Org. Synth. 10: 32; Coll. Vol. 2: 248.
- ^ Reckleben, Hans; Scheiber, Johannes. Über eine einfache Darstellung des Hexamethyl-benzols [A simple representation of hexamethylbenzene]. Ber. Dtsch. Chem. Ges. 1913, 46 (2): 2363–2365 [2021-08-29]. doi:10.1002/cber.191304602168. (原始內容存檔於2021-08-29) (德語).
- ^ Ipatiew, W. N.; Petrow, A. D. Über die katalytische Kondensation des Acetons bei hohen Temperaturen und Drucken (II. Mitteilung) [On the catalytic condensation of acetone at high temperatures and pressures (II. Communication)]. Ber. Dtsch. Chem. Ges. A/B. 1927, 60 (3): 753–755. doi:10.1002/cber.19270600328 (德語).
- ^ Kotanigawa, Takeshi; Shimokawa, Katsuyoshi. The Alkylation of Phenol over the ZnO–Fe2O3 Catalyst. Bull. Chem. Soc. Jpn. 1974, 47 (6): 1535–1536. doi:10.1246/bcsj.47.1535
 .
.
- ^ Kotanigawa, Takeshi. The Methylation of Phenol and the Decomposition of Methanol on ZnO–Fe2O3 Catalyst. Bull. Chem. Soc. Jpn. 1974, 47 (10): 2466–2468. doi:10.1246/bcsj.47.2466
 .
.
- ^ Saunders, Martin; Jiménez-Vázquez, Hugo A.; Khong, Anthony. NMR of 3He Dissolved in Organic Solids. J. Phys. Chem. 1996, 100 (39): 15968–15971. doi:10.1021/jp9617783.
- ^ Ross, Sidney D.; Bassin, Morton; Finkelstein, Manuel; Leach, William A. Molecular Compounds. I. Picryl Chloride-Hexamethylbenzene in Chloroform Solution. J. Am. Chem. Soc. 1954, 76 (1): 69–74. doi:10.1021/ja01630a018.
- ^ (1968) "2,3,4,5,6,6-Hexamethyl-2,4-cyclohexadien-1-one". Org. Synth. 48; Coll. Vol. 5: 598.
- ^ Earhart, H. W.; Komin, Andrew P., Polymethylbenzenes, Kirk-Othmer Encyclopedia of Chemical Technology, New York: John Wiley, 2000, ISBN 9780471238966, doi:10.1002/0471238961.1615122505011808.a01
- ^ 46.0 46.1 46.2 46.3 Fischer, Ernst Otto; Lindner, Hans Hasso. Über Aromatenkomplexe von Metallen. LXXVI. Di-hexamethylbenzol-metall-π-komplexe des ein- und zweiwertigen Kobalts und Rhodiums [About Aromatic Complexes of Metals. LXXVI. Di-hexamethylbenzene metal-π-complexes of mono- and bivalent cobalt and rhodium]. J. Organomet. Chem. 1964, 1 (4): 307–317. doi:10.1016/S0022-328X(00)80056-X (德語).
- ^ Fischer, Ernst Otto; Schmidt, Manfred W. Über Aromatenkomplexe von Metallen, XCI. Über monomeres und dimeres Bis-hexamethylbenzol-rhenium. Chem. Ber. 1966, 99 (7): 2206–2212. doi:10.1002/cber.19660990719.
- ^ Bennett, Martin A.; Huang, T.-N.; Matheson, T. W.; Smith, A. K. 16. (η6-Hexamethylbenzene)Ruthenium Complexes 21. 1982: 74–78. ISBN 9780470132524. doi:10.1002/9780470132524.ch16.
|journal=被忽略 (幫助) - ^ Schäfer, W.; Hellmann, H. Hexamethyl(Dewar Benzene) (Hexamethylbicyclo[2.2.0]hexa-2,5-diene). Angew. Chem. Int. Ed. Engl. 1967, 6 (6): 518–525. doi:10.1002/anie.196705181.
- ^ Paquette, Leo A.; Krow, Grant R.; Bollinger, J. Martin; Olah, George A. Protonation of hexamethyl Dewar benzene and hexamethylprismane in fluorosulfuric acid – antimony pentafluoride – sulfur dioxide. J. Am. Chem. Soc. 1968, 90 (25): 7147–7149. doi:10.1021/ja01027a060.
- ^ Laube, Thomas; Lohse, Christian. X-ray Crystal Structures of Two (deloc-2,3,5)-1,2,3,4,5,6- Hexamethylbicyclo[2.1.1]hex-2-en-5-ylium Ions. J. Am. Chem. Soc. 1994, 116 (20): 9001–9008. doi:10.1021/ja00099a018.
- ^ Jašík, Juraj; Gerlich, Dieter; Roithová, Jana. Probing Isomers of the Benzene Dication in a Low-Temperature Trap. J. Am. Chem. Soc. 2014, 136 (8): 2960–2962. PMID 24528384. doi:10.1021/ja412109h.
- ^ Puiu, Tibi. Exotic carbon molecule has six bonds, breaking the four-bond limit. zmescience.com. ZME Science. 5 January 2017 [14 January 2017]. (原始內容存檔於2017-01-16).
- ^ 54.0 54.1 Haaland, Arne; Samdal, Svein; Seip, Ragnhild. The molecular structure of monomeric methyl(cyclopentadienyl)zinc, (CH3)Zn(η-C5H5), determined by gas phase electron diffraction. J. Organomet. Chem. 1978, 153 (2): 187–192. doi:10.1016/S0022-328X(00)85041-X.
- ^ Elschenbroich, Christoph. Organometallic Compounds of Groups 2 and 12. Organometallics 3rd. John Wiley & Sons. 2006: 59–85 [2021-08-29]. ISBN 9783527805143. (原始內容存檔於2022-04-26).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||




